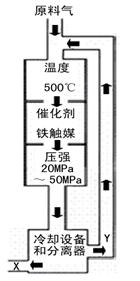
26. (广东省梅州一模)(12分)氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g)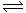 2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
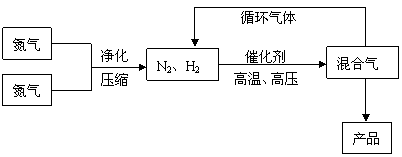
反应体系中各组分的部分性质见下表:
|
气体 |
氮气 |
氢气 |
氨 |
|
熔点(℃) |
-210.01 |
-252.77 |
-77.74 |
|
沸点(℃) |
-195.79 |
-259.23 |
-33.42 |
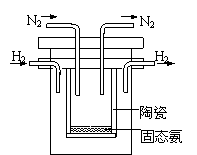
(1)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 使混合气体分离出来产品;继续循环的气体是 。写出该反应的化学平衡常数表达式:K= 。
(2)运用化学反应速率和化学平衡的观点说明工业上采取用上述实际生产措施的理由:
。
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________ ________ 。
(4)合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应: N2(g)+3H2(g)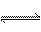 2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
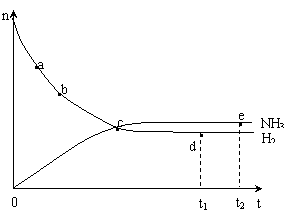 A.点a的正反应速率比点b的大
A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
 D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
(5)1998年希腊亚里斯多德大学的Marmellos和Stoukides
采用高质子导电性的SCY陶瓷(能传递H+),实现了高温
常压下高转化率的电化学合成氨。其实验装置如图。
阴极的电极反应式 。
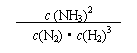
22.(广东省茂名二模)(15分)工业制硫酸生产流程如下图:
|
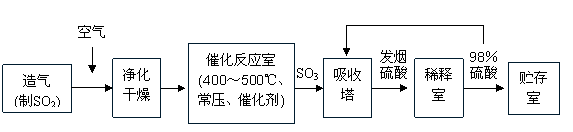

(1)早期生产用黄铁矿为原料,但现在工厂生产硫酸用硫磺为原料,理由是 (2分)
(2)在催化反应室,下列措施中有利于提高SO2平衡转化率的有 (2分)
A.升高温度 B.减少压强
C.不断补充SO2和空气 D.及时分离出SO3
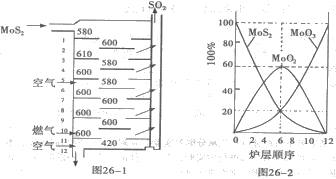
(3)在生产中,为提高催化剂效率采取了哪些措施?
(3分)
(4)已知2SO2(g)+O2(g) 2SO3(g),ΔH=-196 kJ·mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是_______________________________________________________________________________。 (3分)
2SO3(g),ΔH=-196 kJ·mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是_______________________________________________________________________________。 (3分)
(5)经检测生产硫酸的原料气成分(体积分数)为SO27%、O211%、N282%。在500℃,0.1MPa条件下达到平衡时,各种气体的体积比为V(SO2):V(SO3):V(O2):V(N2)=0.46:6.5:7.7:82,则SO2的利用率为 (3分)
(6)在450℃、常压和钒催化条件下,在容积为VL的容器中加入2n molSO2和n molO2,反应达平衡后测得平衡常数为K,此时O2的转化率为x。则K和x的关系满足K= 。(2分)
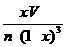 (2分)
(2分) NH3·H2O
NH3·H2O
 (佛山一模)(9分)
(佛山一模)(9分)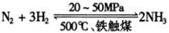 △H <0,生产流程如右图所示。
△H <0,生产流程如右图所示。 ③ 改变反应条件,会使平衡发生移动。下图表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号) ,当横坐标为温度时,变化趋势正确的是(选填字母序号) 。
③ 改变反应条件,会使平衡发生移动。下图表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号) ,当横坐标为温度时,变化趋势正确的是(选填字母序号) 。 Z(g)+2W(g);△H<0。达到平衡(Ⅰ)时,B中密度变为原来的
Z(g)+2W(g);△H<0。达到平衡(Ⅰ)时,B中密度变为原来的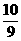 ,试回答:
,试回答: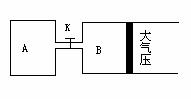 (1)设A、B两容器中化学平衡常数分别为K1和K2,则它们的大小关系是K1____K2(填“大于”或“等于”或“小于”)。
(1)设A、B两容器中化学平衡常数分别为K1和K2,则它们的大小关系是K1____K2(填“大于”或“等于”或“小于”)。