15.在足量的稀氯化亚铁溶液中,加入1-2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是:
(填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物是
(2)现提供以下试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
请判断哪位同学的推断是正确的,并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象。
|
同学正确 |
选用试剂 |
实验现象 |
|
第一种方法 |
|
|
|
第二种方法 |
|
|
(3)根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子是 若选用淀粉碘化钾溶液来判断哪位同学的推断是正确的,你认为是否可行? (填可行或不可行)理由是:
13.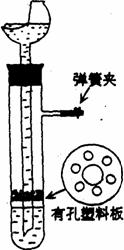 (12分)用图示的装置制取氢气,在塑料隔板上放粗锌粒,漏斗和带支管的试管中装有稀硫酸,若打开弹簧夹,则酸液由漏斗流下,试管中液面上升与锌粒接触,发生反应。产生的氢气由支管导出;若关闭弹簧夹,则试管中液面下降,漏斗中液面上升,酸液与锌粒脱离接触,反应自行停止。需要时再打开弹簧夹,又可以使氢气发生。这是一种仅适用于室温下随制随停的气体发生装置。
(12分)用图示的装置制取氢气,在塑料隔板上放粗锌粒,漏斗和带支管的试管中装有稀硫酸,若打开弹簧夹,则酸液由漏斗流下,试管中液面上升与锌粒接触,发生反应。产生的氢气由支管导出;若关闭弹簧夹,则试管中液面下降,漏斗中液面上升,酸液与锌粒脱离接触,反应自行停止。需要时再打开弹簧夹,又可以使氢气发生。这是一种仅适用于室温下随制随停的气体发生装置。
回答下面问题:
(1)为什么关闭弹簧夹时试管中液面会下降?
(2)这种制气装置在加入反应物前,怎样检查装置的气密性?
(3)从下面三个反应中选择一个可以用这种随制随停的制气装置制取的气体,填写下表中的空白。
① 大理石与盐酸反应制取二氧化碳
② 黄铁矿与盐酸反应制取硫化氢
③ 用二氧化锰催化分解过氧化氢制氧气
|
气体名称 |
收集方法 |
检验方法 |
|
|
|
|
(4)食盐跟浓硫酸反应制氯化氢不能用这种装置随制随停。试说明理由。
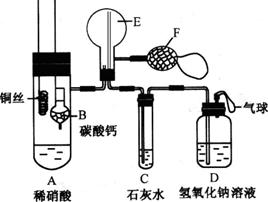 (17分)为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
(17分)为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。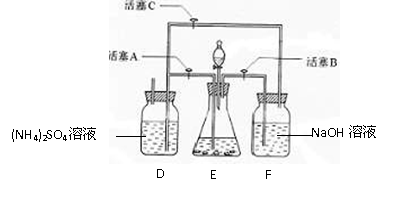 实验步骤:
实验步骤: (12分)已知1,2−二氯乙烷在常温下为无色液体,沸点83.5℃,密度为1.23g·cm−3,难溶于水,易溶于有机溶剂。乙醇的沸点为78.5℃。某化学课外活动小组为探究1,2−二氯乙烷的消去反应,设计了如下实验
(12分)已知1,2−二氯乙烷在常温下为无色液体,沸点83.5℃,密度为1.23g·cm−3,难溶于水,易溶于有机溶剂。乙醇的沸点为78.5℃。某化学课外活动小组为探究1,2−二氯乙烷的消去反应,设计了如下实验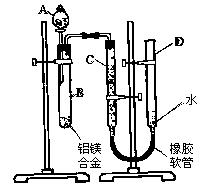 (10分)某学习小组用下图装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
(10分)某学习小组用下图装置测定铝镁合金中铝的质量分数和铝的相对原子质量。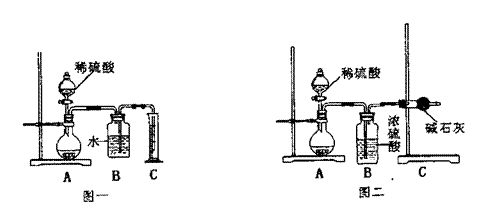 (14分)为了测定氢氧化钠固体混合物mg中碳酸钠的质量分数,某探究活动小组分别设计了如下实验方案:
(14分)为了测定氢氧化钠固体混合物mg中碳酸钠的质量分数,某探究活动小组分别设计了如下实验方案: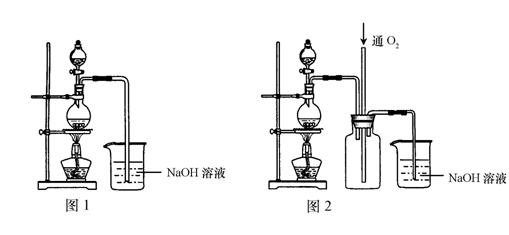
 N2+3Cu+3H2O
N2+3Cu+3H2O 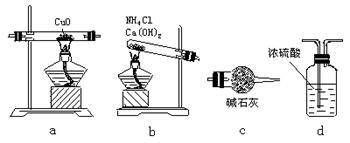
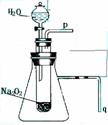 a.有氧气生成; b.
。
a.有氧气生成; b.
。