13.向一密闭容器中加入2mol A、0.6molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如附图一所示。附图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3-t4阶段为使用催化剂;图一中t0-t1阶段c(B)未画出。
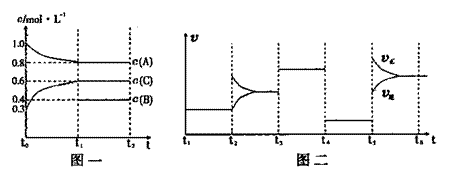
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)= 。
(2)t4-t5阶段改变的条件为 ,B的起始物质的量为 。
该反应方程式可表示为
各阶段平衡时对应的平衡常数如下表所示:
|
t1-t2 |
t2-t3 |
t3-t4 |
t4-t5 |
t5-t6 |
|
K1 |
K2 |
K3 |
K4 |
K5 |
则K1= (保留两位小数),K1、K2、K3、K4、K5之间的关系为
K1 K2 K3 K4 K5 (用“>”、“<”或“=”连接)
(3)在相同条件下,若起始时容器中加入a molA、bmolB和cmolC,要达到t1时刻同
样的平衡(各物质的百分含量相同),a、b、c要满足的条件为 。
(含a,b,c的代数式表示)
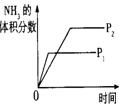
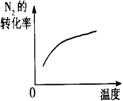
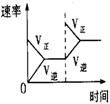
10.对于可逆反应N2(g)+3H2(g)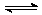 2NH3(g);△H<0,下列研究目的和示意图相符的是C
2NH3(g);△H<0,下列研究目的和示意图相符的是C
|
|
A |
B |
C |
D |
|
研究目的 |
压强对反应的影响(P2>P1) |
温度对反应的影响 |
平衡体系增加N2对反应的影响 |
催化剂对反应的影响 |
|
图示 |
 |
 |
 |
 |
 有可逆反应A(g)+3B(g) 2C(g)+Q(Q>0)
有可逆反应A(g)+3B(g) 2C(g)+Q(Q>0)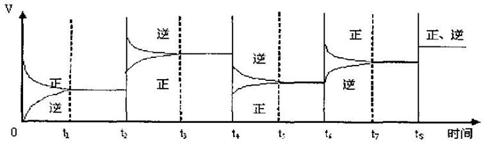
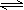 (16分)如下图,甲、乙、丙分别表示在不同条件下可逆反应:A(g)+B(g) xC(g)
(16分)如下图,甲、乙、丙分别表示在不同条件下可逆反应:A(g)+B(g) xC(g)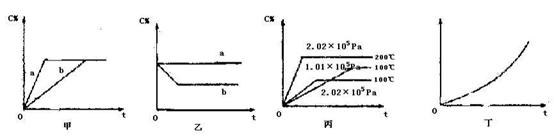
 2X(气)
2X(气)  2Y(气)+Z(气) △H=Q kJ·mol-1(Q<0)在t1时刻达到平衡,然后在t2时刻开始加热到一定温度后停止加热并保温,到t3时刻又建立平衡,下图能表示这一变化的是 B
2Y(气)+Z(气) △H=Q kJ·mol-1(Q<0)在t1时刻达到平衡,然后在t2时刻开始加热到一定温度后停止加热并保温,到t3时刻又建立平衡,下图能表示这一变化的是 B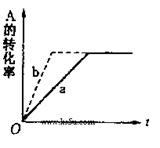
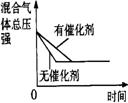
 已知反应在密闭容器中进行,化学方程式为A(g)+2B(g) 3C(g)+D(s),反应放出热量。图中a曲线代表一定条件下该
已知反应在密闭容器中进行,化学方程式为A(g)+2B(g) 3C(g)+D(s),反应放出热量。图中a曲线代表一定条件下该 向某密闭容器中加入0.3 molA 、0.1 molC 和一定量的 B 三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0-t1阶段 c ( B)未画出]。附图乙为 t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件均不同。已知,t3-t4阶段为使用催化剂。下列说法正确的是:AD
向某密闭容器中加入0.3 molA 、0.1 molC 和一定量的 B 三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0-t1阶段 c ( B)未画出]。附图乙为 t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件均不同。已知,t3-t4阶段为使用催化剂。下列说法正确的是:AD B(g) + 2C(g);ΔH=+100akJ·mol-1
B(g) + 2C(g);ΔH=+100akJ·mol-1