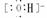1、钠及其化合物:
(1)钠的物理性质:银白色固体,导热、电导,质软、密度小、熔点低。
(2)钠与水反应:2Na+2H2O=2NaOH+H2↑
(3)钠保存在煤油中,空气中的变化过程:最终变为Na2CO3☆☆☆☆☆
Na → Na2O →NaOH → Na2CO3·12H2O →Na2CO3
(4)碳酸钠与碳酸氢钠的性质比较:☆☆☆☆☆
|
名称 |
碳酸钠 |
碳酸氢钠 |
|
化学式 |
Na2CO3 |
NaHCO3 |
|
俗名 |
纯碱、苏打 |
小苏打 |
|
溶解性 |
|
溶解度比碳酸钠小 |
|
热稳定性 |
--- |
2NaHCO3 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
|
与盐酸反应 |
Na2CO3+2HCl=2NaCl+H2O+CO2↑ |
比Na2CO3剧烈NaHCO3+HCl=NaCl+H2O+CO2↑ |
|
与NaOH反应 |
--- |
NaHCO3+NaOH=Na2CO3+H2O |
|
相互转化 |
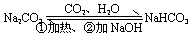 |
①除杂:Na2CO3固体(混有少量NaHCO3)-----充分 加热
Na2CO3溶液(混有少量NaHCO3)-----加适量NaOH溶液
②鉴别碳酸钠和碳酸氢钠两种物质的方法:
固体:加热有气体出现的是碳酸氢钠;溶液:加氯化钙溶液有沉淀的是碳酸钠
 NH3·H2O
NH3·H2O CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O 4NO+6H2O(能进行氧化还原反应分析。)
4NO+6H2O(能进行氧化还原反应分析。)





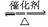 △还原性:2SO2+O2 2SO3
△还原性:2SO2+O2 2SO3 物理性漂白---吸附作用-----活性炭(例:红糖→白糖)
物理性漂白---吸附作用-----活性炭(例:红糖→白糖) 碱性干燥剂---碱石灰、氧化钙等---干燥碱性气体、中性气体例NH3、H2等
碱性干燥剂---碱石灰、氧化钙等---干燥碱性气体、中性气体例NH3、H2等



 O2
O2
H2O
NaOH
O2
O2
H2O
NaOH

 Si+2Cl2
SiCl4
Si+2Cl2
SiCl4 Fe3O4
Fe3O4  质子 Z
质子 Z  Cl2
Cl2 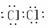 N2
N2 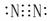 HCl
HCl 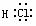 H2O
H2O CO2
CO2 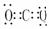 NH3
NH3 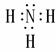 CH4
CH4
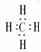
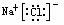 MgCl2
MgCl2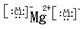 NaOH Na+
NaOH Na+