20.(12分)据报道,有一种叫Thibacillus Ferroxidans的细菌在氧气存在下的酸性溶液中,能将黄铜矿(CuFeS2)氧化成硫酸盐。发生的反应为:
4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
(1)CuFeS2中Fe的化合价为+2,上述反应中被氧化的元素是 。
(2)工业生产中利用上述反应后的溶液,按如下流程可制备胆矾(CuSO4·5H2O):
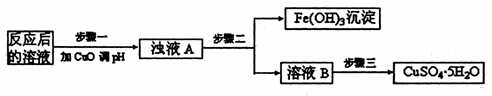
①分析下列表格(其中KSP是相应金属氢氧化物的沉淀溶解平衡常数):
|
|
Ksp |
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ |
2.6×10-39 |
1.9 |
3.2 |
|
Cu2+ |
2.2×10-20 |
4.7 |
6.7 |
步骤一应调节溶液的pH范围是 。请运用沉淀溶解平衡的有关理论解释加入CuO能除去CuSO4溶液中Fe3+的原因
。
②步骤三中的具体操作方法是 。
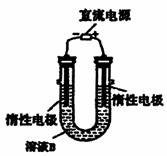
(3)有人提出可以利用右图的装置从溶液B中提炼金属铜。该过程中右边电极的反应式是
,总反应的方程式是 。
 (4)工业上冶炼铜的方法之一为:
(4)工业上冶炼铜的方法之一为:
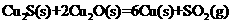

已知:①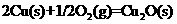
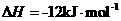
②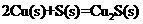
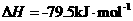
③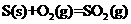
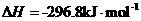
则该法冶炼铜的反应中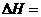 。
。
19.(8分)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知: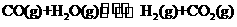 的平衡常数随温度的变化如下表:
的平衡常数随温度的变化如下表:
|
温度/℃ |
400 |
500 |
830 |
1000 |
|
平衡常数K |
10 |
9 |
1 |
0.6 |
试回答下列问题
(1)上述反应的正反应是 反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率
(填“增大”、“减小”或“不变”),容器内混合气体的压强 (填“增大”、“减小”或“不变”)。
(3)830℃,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有 (选填A、B、C、D)。
|
|
A |
B |
C |
D |
|
n(CO2) |
3 |
1 |
0 |
1 |
|
n(H2) |
2 |
1 |
0 |
1 |
|
n(CO) |
1 |
2 |
3 |
0.5 |
|
n(H2O) |
5 |
2 |
3 |
2 |

(4)830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,CO的转化率是 。
 A.含有10个中子的氧原子
A.含有10个中子的氧原子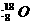 B.乙烯的最简式(实验式):
B.乙烯的最简式(实验式):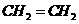
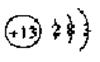 C.
C.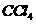 的电子式: D.铝离子的结构示意图
的电子式: D.铝离子的结构示意图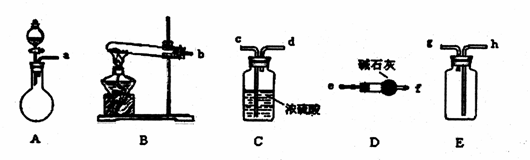 (12分)在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。下图所示A-E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
(12分)在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。下图所示A-E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。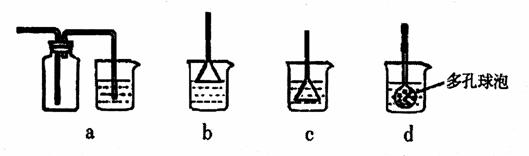 (3)向浓CaCl2溶液中通入NH3和CO2气制纳米级碳酸钙时,应先通入的气体是
,若实验过程中有氨气逸出,应选用下列
装置回收(填代号)。
(3)向浓CaCl2溶液中通入NH3和CO2气制纳米级碳酸钙时,应先通入的气体是
,若实验过程中有氨气逸出,应选用下列
装置回收(填代号)。
 A.含有大量
A.含有大量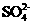 的溶液中肯定不存在
的溶液中肯定不存在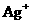
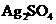 的溶度积常数(
的溶度积常数(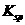 )为1×10-3
)为1×10-3