摘要: 水的电离平衡如图所示: (1)若A点表示25℃时水的电离平衡状态.当温度上升 到100℃时.水的电离平衡状态到达B点.则此时 水的离子积从 增加到 . (2)将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合.并保持100℃时的 恒温.于是混合物溶液的pH=7.则Ba(OH)2与盐酸溶液的体积比 (3)100℃时.若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中 性.则混合之前.该强酸的pH与强碱的pH之间应满足的关系是
网址:http://m.1010jiajiao.com/timu3_id_432298[举报]
水的电离平衡如图所示:
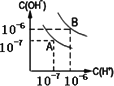
(1)若A点表示25℃时水的电离平衡状态,当温度上升到100℃时,水的电离平衡状态到达B点.则此时水的离子积从________增加到________.
(2)将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃时的恒温,于是混合物溶液的pH=7,则Ba(OH)2与盐酸溶液的体积比________
(3)100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH与强碱的pH之间应满足的关系是________
水的电离平衡如图1-2-13所示:
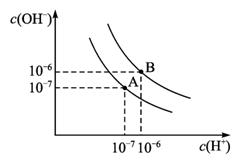
图1-2-13
(1)若A点表示25℃时水的电离平衡状态,当温度升高至100℃时水的电离平衡状态为B点,则此时水的离子积从_________增加到_________。
(2)将100℃ pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃恒温,欲使混合液的pH=7,则Ba(OH)2与盐酸的体积比为_________。
(3)向纯水中加入NaHSO4(温度不变)则溶液的_________。
A.pH升高 B.pH降低
C.c(H+)·c(OH-)增大 D.c(H+)>c(OH-)
查看习题详情和答案>> 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.(1)若以A点表示25℃时水的电离平衡的离子浓度,当温度升高到100℃时,水的电离平衡状态移动到B点,则此时水的离子积从
10-14
10-14
变化到10-12
10-12
.(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,致使混合溶液的pH=7,则Ba(OH)2和盐酸的体积比为
2:9
2:9
.(3)已知AnBm的离子积为[c(Am+)]n[c(Bn-)]m,式中c(Am+)n和c(Bn-)m表示离子的物质的量浓度.在某温度下,Ca(OH)2的溶解度为0.74g,其饱和溶液密度设为1g/mL,其离子积约为
4×10-3
4×10-3
. 水的电离平衡曲线如图所示.?
水的电离平衡曲线如图所示.?(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从
10-14
10-14
增加到10-12
10-12
.(2)将常温下的pH=8的Ba(OH)2溶液升至100℃,则Ba(OH)2溶液的pH:
B
B
.A、>10 B、=6 C、6~8 D、>8 E、不能确定
(3)已知AnBm的离子积=[c(Am+)]n?[c(Bn-)]m?,式中c(Am+)n和c(Bn-)m表示离子的物质的量浓度幂.在某温度下,Ca(OH)2的浓度为0.02mol?L-1,其离子积为
3.2×10-5mol3/L3
3.2×10-5mol3/L3
. 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从
10-14
10-14
增加到10-12
10-12
.(2)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为
2:9
2:9
.(3)在某温度下,Ca(OH)2的溶解度为0.74g,其饱和溶液密度设为1g/mL,Ca(OH)2的离子积为
4×10-3
4×10-3
.(4))25℃时,在等体积的 ①pH=0的H2SO4溶液、②0.05mol/L的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
1:10:1010:109
1:10:1010:109
.