摘要:第Ⅱ卷请用蓝.黑色钢笔或圆珠笔直接写在答题卷上
网址:http://m.1010jiajiao.com/timu3_id_431562[举报]
 物质结构与性质
物质结构与性质短周期非金属元素A、B、C的核电荷数依次增大,A原子的外围电子排布式为ns2np2,C是地壳中含量最多的元素.元素D、E都位于第四周期,其中E的核电荷数为29,D原子的核外未成对电子数在同周期中是最多的.请用对应的元素符号或化学式填空:
(1)元素A、B、C的第一电离能由小到大的顺序为
C<O<N
C<O<N
.(2)已知(AB)2分子中键与键之间的夹角为180°,并有对称性,且每个原子的最外层电子均满足8电子结构,则其结构式为
N≡C-C≡N
N≡C-C≡N
,1mol该分子中含有的π键的数目为4NA
4NA
.(3)基态D原子的外围电子排布式为
3d54s1
3d54s1
.化合物DO2Cl2的熔点是-96.5℃,沸点是117℃,则固态DO2Cl2属于分子
分子
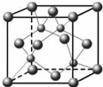
晶体.(4)已知元素E的氢化物的晶胞结构如图所示,则其化学式为
CuH
CuH
. (2013?聊城一模)【化学--物质结构与性质】
(2013?聊城一模)【化学--物质结构与性质】A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为
C<O<N
C<O<N
.(2)A的最高价氧化物对应的水化物分子中其中心原子采取
sp2
sp2
杂化.(3)与A、B形成的阴离子(AB-)互为等电子体的分子有
N2、CO
N2、CO
.(4)基态D原子的核外电子排布式为
1s22s22p63s23p63d104s1
1s22s22p63s23p63d104s1
,右图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比为1:5
1:5
.(5)向D的高价态硫酸盐溶液中逐滴滴加B的氢化物水溶液至过量,先出现沉淀,最后沉淀溶解形成溶液.写出此沉淀溶解的离子方程式:
Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O
Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O
.下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处,请用相应的化学用语或符号回答下列问题:
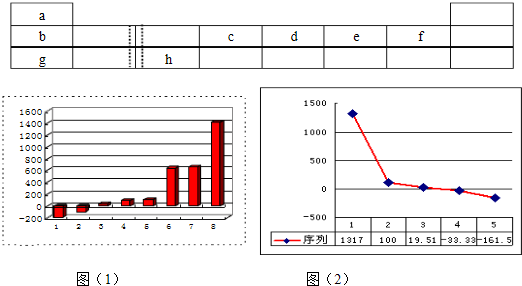
(1)上图(1)是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表的是
(2)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(2),序列“5”的氢化物的名称是
 .
.
(3)e元素与f元素相比,电负性f大于e,下列表述中能证明这一事实的是
A.常温下f单质的颜色比e单质的颜色深
B.f单质与e的氢化物剧烈反应,产生e的单质
C.f与e形成的化合物中e元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)科学家证实,氯化铝属于共价化合物,分子式为Al2Cl6,且每种元素均满足8电子的结构,请写出你认为正确的Al2Cl6结构是
 .
.
(5)叠氮化物是一类重要化合物,在炸药、磁性化合物研究、微量元素测定方面越来越引起人们的重视,由叠氮化钠(Sodium azida)NaN3热分解可得光谱纯N2:2NaN3(s)→2Na(l)+3N2(g),有关说法正确的是
A.钠晶胞结构如右图,钠晶胞中每个钠原子的配位数为6
B.钠晶胞结构如右图,晶胞中分摊2个钠原子
C.氮的电负性大于氧
D.Na+的半径小于N3-的半径.
查看习题详情和答案>>

(1)上图(1)是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表的是
原子
原子
晶体(填晶体的类型).(2)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(2),序列“5”的氢化物的名称是
甲烷
甲烷
,序列“2”的氢化物的结构式为

(3)e元素与f元素相比,电负性f大于e,下列表述中能证明这一事实的是
BC
BC
(填选项序号)A.常温下f单质的颜色比e单质的颜色深
B.f单质与e的氢化物剧烈反应,产生e的单质
C.f与e形成的化合物中e元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)科学家证实,氯化铝属于共价化合物,分子式为Al2Cl6,且每种元素均满足8电子的结构,请写出你认为正确的Al2Cl6结构是



(5)叠氮化物是一类重要化合物,在炸药、磁性化合物研究、微量元素测定方面越来越引起人们的重视,由叠氮化钠(Sodium azida)NaN3热分解可得光谱纯N2:2NaN3(s)→2Na(l)+3N2(g),有关说法正确的是
BD
BD
(选填序号)A.钠晶胞结构如右图,钠晶胞中每个钠原子的配位数为6
B.钠晶胞结构如右图,晶胞中分摊2个钠原子
C.氮的电负性大于氧
D.Na+的半径小于N3-的半径.
 (2012?江苏一模)A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式填空:
(2012?江苏一模)A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式填空:(1)A、B、C的第一电离能由小到大的顺序为
C<O<N
C<O<N
.(2)A的最高价氧化物对应的水化物分子中其中心原子采取
sp2
sp2
杂化.(3)已知A、C形成的化合物分子甲与B的单质分子结构相似,1mol甲中含有π键的数目为
2NA(或1.204×1024)
2NA(或1.204×1024)
.(4)D的核外电子排布式是
1s22s22p63s23p63d104s1(或[Ar]3d104s1)
1s22s22p63s23p63d104s1(或[Ar]3d104s1)
,它的高价离子与B的简单氢化物形成的配离子的化学式为[Cu(NH3)4]2+
[Cu(NH3)4]2+
.(5)D的氢化物的晶体结构如图所示,写出此氢化物在氯气中燃烧的化学方程式
2CuH+3Cl2
2CuCl2+2HCl
| ||
2CuH+3Cl2
2CuCl2+2HCl
.
| ||
(8分)下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处,请用相应的化学用语或符号回答下列问题:
| a | | | | | | | |
| b | | | c | d | e | f | |
| g | | h | | | | | |

(1)上图(1)是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表的是 晶体(填晶体的类型)。
(2)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(2),序列“5”的氢化物的名称是
,序列“2”的氢化物的结构式为 。
(3)e元素与f元素相比,电负性f大于e,下列表述中能证明这一事实的是 (填选项序号)
A.常温下f单质的颜色比e单质的颜色深
B.f单质与e的氢化物剧烈反应,产生e的单质
C.f与e形成的化合物中e元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)科学家证实,氯化铝属于共价化合物,分子式为Al2Cl6,且每种元素均满足8电子的结构,请写出你认为正确的Al2Cl6结构是_______________。
(5)叠氮化物是一类重要化合物,在炸药、磁性化合物研究、微量元素测定方面越来越引起人们的重视,由叠氮化钠(Sodium azida)NaN3热分解可得光谱纯N2:2NaN3(s)→2Na(l)+3N2(g),有关说法正确的是_____________(选填序号)

A.钠晶胞结构如图,钠晶胞中每个钠原子的配位数为6
B.钠晶胞结构如图,晶胞中分摊2个钠原子
C.氮的电负性大于氧
D.Na+的半径小于N3-的半径 查看习题详情和答案>>