0.1000mol/LNaOH标准溶液;
100mL容量瓶,10ml移液管,碱式滴定管,铁架台,滴定管夹,锥形瓶,烧杯,酸碱指示剂(可供选用的有:甲基橙,酚酞,石蕊)。
[实验步骤]
① 配制并移取待测食醋溶液
用10mL移液管吸取10mL市售白醋样品置于100mL容量瓶中,用处理过的蒸馏水稀释至刻度线,摇匀后用酸式滴定管取待测食醋溶液20mL,并移至锥形瓶中。
② 盛装标准NaOH溶液
将碱式滴定管洗净后,用NaOH标准溶液润洗3次,然后加入NaOH标准溶液,排除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下。静置,读取数据并记录为NaOH标准溶液体积的初读数。
③ 滴定
往盛有待测食醋溶液的锥形瓶中滴加某酸碱指示计2-3滴,滴定至终点。记录NaOH的终读数。重复滴定3次。
[数据记录]
|
滴定次数 实验数据 |
1 |
2 |
3 |
4 |
|
V(样品)/mL |
20.00 |
20.00 |
20.00 |
20.00 |
|
V (NaOH)始/mL |
0.00 |
0.20 |
0.10 |
0.10 |
|
V (NaOH)终/mL |
14.98 |
15.20 |
15.12 |
16.24 |
[问题与思考]
⑴ 步骤①中中还需补充的仪器有 ▲ 。蒸馏水的处理方法是 ▲ 。
⑵ 步骤③中你选择的酸碱指示剂是 ▲ ,理由是 ▲ 。
⑶ 若用深色食醋进行实验,为准确判断滴定终点,可采取的措施是 ▲ 。
⑷ 样品总酸量= ▲ g/100mL。
命题、审校人:魏书彬 陈家柱
江苏省洪泽中学2010-2011学年度高三联合考试
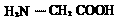 氨基乙酸 B.
氨基乙酸 B. 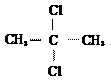 2-二氯丙烷
2-二氯丙烷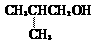 2-甲基丙醇 D.
2-甲基丙醇 D. 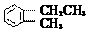 2-乙基甲苯
2-乙基甲苯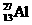 得到一种自然界不存在的核素
得到一种自然界不存在的核素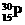 ,开创了人造核素的先河。其发生的变化可表示如下:
,开创了人造核素的先河。其发生的变化可表示如下: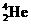 →
→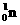 。下列有关说法错误的是
。下列有关说法错误的是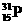 两种核素互为同位素 B. 在
两种核素互为同位素 B. 在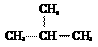 B. Li原子的轨道表示式:
B. Li原子的轨道表示式: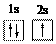
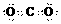 D. 饱和醇的通式:CnH2n+2O
D. 饱和醇的通式:CnH2n+2O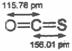 (1)钴原子在基态时核外电子排布式为 ▲ 。
(1)钴原子在基态时核外电子排布式为 ▲ 。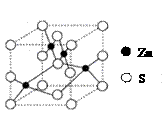 C.H2S分子呈V形结构
C.H2S分子呈V形结构