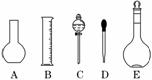
(一)物质的分离与提纯的基本实验方法
1、过滤:适用于分离一种组分可溶,另一种不溶的固态混合物的分离。如:粗盐与泥沙的分离提纯。主要仪器:漏斗、玻璃棒、烧杯。
2、蒸发结晶:适用于混合物中各组分物质在溶剂中溶解性的差异的分离提纯 如:NaCl中混有KNO3分离提纯。主要仪器:蒸发皿、玻璃棒、酒精灯。
3、蒸馏法:适用于分离各组分互溶,但沸点不同的液态混合物。如:酒精与水的分离。主要仪器:蒸馏烧瓶、冷凝器。
4、分液:分离互不相容的两种液体。主要仪器:分液漏斗、铁架台、铁圈。
5、萃取:溶质在互不相溶的溶剂里溶解度不同,利用萃取剂将溶质从另一溶液中分离出来。主要仪器:分液漏斗。
附:溴和碘在水溶液和有机溶剂(苯或四氯化碳)中的颜色
|
|
单质 |
水溶液 |
有机溶剂(苯或四氯化碳) |
|
溴 |
深红棕色液体 |
浅黄色→黄色 |
橙色→橙红色 |
|
碘 |
紫黑色固体 |
黄色→棕黄色 |
浅紫色→紫色 |
 四种基本反应类型与氧化还原反应的关系:
四种基本反应类型与氧化还原反应的关系: H++Cl-+HclO (Cl2不会全部参与反应)
H++Cl-+HclO (Cl2不会全部参与反应) 溶液
溶液 烃
烃 有机化合物
有机化合物 非金属
非金属 强酸HCl、H2SO4、HNO3
强酸HCl、H2SO4、HNO3 弱酸
弱酸 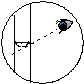 仰视、俯视对溶液浓度有何影响?
仰视、俯视对溶液浓度有何影响? (2)仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。
(2)仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。 NH3↑+H2O
NH3↑+H2O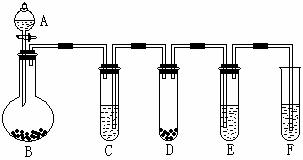

 装置F中:
( 化学方程式) 反应类型:
装置F中:
( 化学方程式) 反应类型:
 ⑶上图所示的B-F装置中,发生了氧化还原反应的是 (填装置编号)。
⑶上图所示的B-F装置中,发生了氧化还原反应的是 (填装置编号)。