28. (14分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(14分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
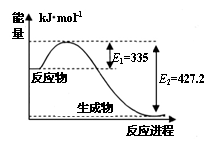
(1)右图是N2和H2反应生成34gNH3过程中能量
变化示意图,则生成1molNH3所放出的热量
为 kJ。
(2)在固定体积的密闭容器中,进行合成氨的反应,
测得压强变化和NH3的含量关系如下表所示,
请完成下列问题:
|
压强(MPa) |
1 |
5 |
10 |
30 |
60 |
100 |
|
NH3% |
2.0 |
9.2 |
16.4 |
35.5 |
53.6 |
69.4 |
①结合实验数据,你得出的结论是: 。
②下列能判断该反应达到化学平衡状态的依据是: (填序号)。
A.v(N2)(正) =3v(H2)(逆) B.容器内N2、H2、NH3的浓度之比为1∶3∶2
C.混合气体的密度保持不变 D.NH3的生成速率等于NH3的分解速率
E.容器内压强保持恒定 F.混合气体的平均相对分子质量保持不变
(3)若有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 mol N2和3 mol H2,
在一定条件下到达平衡时放出热量为Q1 kJ;在相同的条件下,向乙容器中加入
2 mol NH3达到平衡后吸收热量为Q2 kJ,已知Q2=3Q1。则甲容器中H2的转化率
为 。
(4)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电
解法合成,大大提高了氮气和氢气的转化率。总反应式为:N2+3H2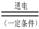 2NH3。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为
。
2NH3。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为
。
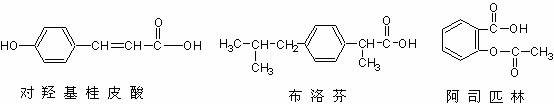
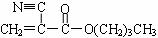 )。
)。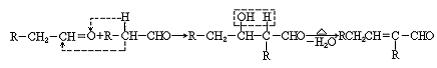 已知 ① 两个醛分子在一定条件下可以发生如下反应:
已知 ① 两个醛分子在一定条件下可以发生如下反应:


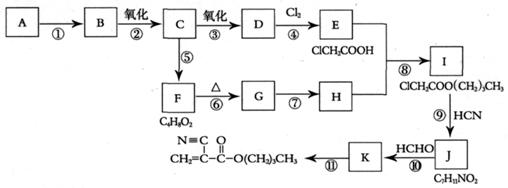
 (15分)A、B、C、D是中学化学的常见
(15分)A、B、C、D是中学化学的常见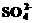 )>c(
)>c(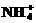 )>c(Fe2+)>c(H+)>c(OH-)
)>c(Fe2+)>c(H+)>c(OH-)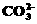 )+c (
)+c (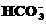 )
) 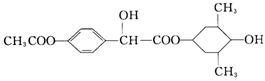 德国医学家通过大量的临床实验证明
德国医学家通过大量的临床实验证明 、
、 、Fe2+、
、Fe2+、