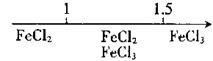21.下表是元素周期表的一部分。
 族
周期 族
周期 |
I A |
II
A |
III
A |
IV
A |
V A |
VI
A |
VII
A |
|
一 |
|
|
|||||
|
二 |
a |
|
|
b |
d |
|
e |
|
三 |
|
f |
g |
|
|
h |
j |
(1)表中元素的单质中熔点最高的可能是___(填元素符号);写出a的氯化物的电子式 ;e、f、h形成的简单离子的半径由大到小顺序依次为______________(填离子符号);
(2)在一定条件下,j与d可形成一种化合物,常温下为淡黄色液体,则其晶体类型为__;该物质遇水强烈水解,生成两种产物,其中之一的分子构型为三角锥形,另一种物质具有漂白性,写出相关反应的化学方程式___________________________;
(3)现有一种元素,其原子获得一个电子所释放出能量是上表中所列元素中最大的,该元素是表中_____元素(填编号);
(4)在g的单质中添加f单质,形成物质k,则g、f、k中硬度最大的是_____(填物质名称)。
(5)若制得117号元素,按元素周期表中金属与非金属的分区,它应是一种
(选填“金属”“非金属”)元素,写出117号元素最外层电子排布式 。
(6)试用短周期元素,写出两种中心原子杂化轨道类型不同的AB3型分子的化学式
、 。
20. (10分)用沉淀法测定NaHCO3和K2CO3混合物的组成。实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液500mL,每次实验均充分反应。实验记录如下:
|
实验次数 |
样品质量/g |
沉淀质量/g |
|
1 |
1.716 |
2.758 |
|
2 |
2.574 |
|
|
3 |
3.432 |
5.516 |
|
4 |
4.290 |
5.516 |
回答下列问题:
(1)第2次实验中产生沉淀质量是多少,将结果填入表格空白处。
(2)Ba(OH)2溶液中溶质的物质的量浓度是 。
(3)第2次实验样品中NaHCO3的物质的量是 。
(4)室温下取第2组实验所得溶液体积的1/10,加水配成500mL溶液,求稀释以后溶液的pH?(要求书写计算过程)
4、温度变化也可能使化学平衡向左移动,抑制配合物的形成。
[实验准备]
(1)CuSO4溶液的准备:分别取3份8g无水CuSO4固体,各加入水稀释到100ml、50 ml、25 ml(第三种溶液已饱和);
(2)NaBr溶液的准备:分别取2.06g、4.12g、4.12gNaBr晶体,各加入水稀释到50 ml、50 ml、25 ml。
问题1:粗略配制上述溶液需要用到的仪器有:
;
[实验现象]
表1、不同浓度的Br-溶液与某一浓度的Cu2+溶液反应
|
编号 |
5 mlCu2+溶液(mol·L-1) |
10 ml Br-溶液(mol·L-1) |
现象 |
|
① |
第一份CuSO4溶液 |
a |
溶液由蓝色变为蓝绿色 |
|
② |
第一份CuSO4溶液 |
b |
溶液由蓝色变为草绿色 |
|
③ |
第一份CuSO4溶液 |
c |
溶液由蓝色变为亮绿色 |
表2、不同浓度的Cu2+溶液与某一浓度的Br-溶液反应
|
编号 |
5 mlCu2+溶液(mol·L-1) |
10 ml Br-溶液(mol·L-1) |
现象 |
|
① |
d |
第一份NaBr溶液 |
溶液由蓝色变为蓝绿色 |
|
② |
e |
第一份NaBr溶液 |
溶液由蓝色变为草绿色 |
|
③ |
f |
第一份NaBr溶液 |
溶液由蓝色变为亮绿色 |
表3、不同温度对配合物形成的影响
|
编号 |
5 mlCu2+溶液(mol·L-1) |
10 ml Br-溶液(mol·L-1) |
温度 |
现象 |
|
① |
第一份CuSO4溶液 |
第一份NaBr溶液 |
25℃ |
溶液由蓝色变为蓝绿色 |
|
② |
第一份CuSO4溶液 |
第一份NaBr溶液 |
60℃ |
溶液由蓝色变为草绿色 |
|
③ |
第一份CuSO4溶液 |
第一份NaBr溶液 |
75℃ |
溶液由蓝色变为亮绿色 |
问题2:上表中b= mol/L e= mol/L;
问题3:通过表3得出的结论是 ;
问题4:上述反应根据的原理是 。

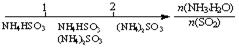
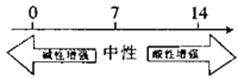
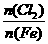 的关系:
的关系: