26.(12分)
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知: 平衡常数随温度的变化如下表:
平衡常数随温度的变化如下表:
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数K |
9.94 |
9 |
1 |
试回答下列问题
(1)上述正向反应是: 反应(填“放热”,或“·吸热”)
(2)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有 (选填A、B、C、D、E)。
|
|
n (CO) |
n (H2O) |
n (H2) |
n (CO2) |
|
A |
1 |
5 |
2 |
3 |
|
B |
2 |
2 |
1 |
1 |
|
C |
3 |
3 |
0 |
0 |
|
D |
0.5 |
2 |
1 |
1 |
|
E |
3 |
1 |
2 |
1 |
(3)已知在一定温度下, 平衡常数K;
平衡常数K;
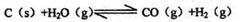 平衡常数K l;
平衡常数K l;
 平衡常数K2
平衡常数K2
则K、Kl、K2之间的关系是: 。
(4)若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,求该条件下CO的平衡转化率。写出计算过程。
(5)在VL密闭容器中通入10 mol CO和10 mo1水蒸气,在T℃达到平衡,然后急速通过碱石灰,将所得混合气体燃烧,测得放出的热量为2842kJ(己知CO燃烧为283kJ/mol,H2燃烧热为286/kJm01),则T℃平衡常数K= 。
2008-2009学年度华南师大附中高三综合测试
25.(11分)
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究Fe2O3、Cu2O的红色粉末混合物。实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4.5H.2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
|
物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀pH |
4.7 |
7.0 |
1.9 |
|
沉淀完全pH |
6.7 |
9.0 |
3.2 |
实验室有下列试剂可供选择:氯水H2O2 NaOH Cu2(OH)2CO3
实验小组设计如下实验方案:
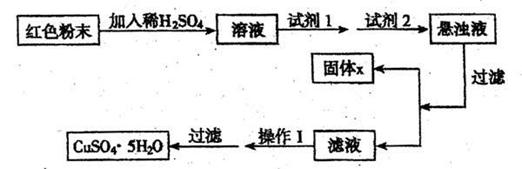
试回答:
(1)请写出红色粉末加入稀H2SO4后,发生反应的离子方程式:
(2)试剂I为 ,你选择的理由是 。
(3)试剂Ⅱ为 ,你选择的理由是 。
20.(17分)
粗盐提纯的研究。
[有关资料]
|
化学式 |
CaCO3 |
CaSO4 |
Ca(OH)2 |
MgCO3 |
Mg(OH)2 |
|
Ksp |
2.8×10一9 |
9.1×10一6 |
1.0×10一4 |
3.5×10一5 |
1.6×10一11 |
某研究性学习小组对粗盐的提纯和检验进行研究,并提出一些新的方案。已知该粗盐样品中主要含有不溶性杂质、Mg2+、Ca2+等(忽略SO42-的存在),该小组设计流程如下:
[设计除杂过程]
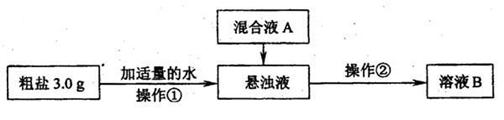
(1)操作①中需要使用的玻璃仪器有(i) 、(ii) 。操作②的名称为(iv) ,若在操作②结束后发现溶液B略有浑浊,应采取的措施是(iv) ;
(2)混合液A的主要成分是 。(填化学式)
[检验除杂效果]
(3)为检验溶液B中Mg2+、Ca2+是否除尽,通常分别取少量溶液B于两支试管中。进行如下实验:
步骤一:检验Mg2+是否除尽。向其中一支试管中加入 溶液(填化学式),如果没有沉淀生成,则Mg2+已除尽。
步骤二:检验Ca2+是否除尽。向另一支试管中加入某溶液,如果没有沉淀生成,则Ca2+已除尽,效果最好的是 (填字母)。
A.Na2 CO3 B.Na2SO4 C.NaOH
[获取纯净食盐]
(4)对溶液B加热并不断滴加l mol· L一1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C。该操作的目的是 。用试纸测pH值的实验操作为 。
(5)将溶液C倒入 (填仪器名称)中,加热蒸发并用玻璃棒不断搅拌,直到 时(填现象),停止加热。
[问题讨论]
(6)进行操作②前,需先加热,其目的是
,该操作中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,此时溶解B中Mg2+物质的量浓度为 。
 再加入CC14,Cu(HDz)2就很容易被萃取到CC14中。
再加入CC14,Cu(HDz)2就很容易被萃取到CC14中。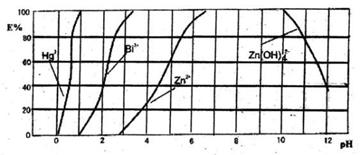
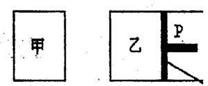 (9分)
(9分)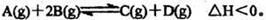 在相同温度下,将1mol A和2tool B加入串容器中,将2mol C~2mo1 D加入乙容器中,t1=5 min时两容器内均达到平衡状态,甲中c(C)=1.5 tool/L。请回答下列问题:
在相同温度下,将1mol A和2tool B加入串容器中,将2mol C~2mo1 D加入乙容器中,t1=5 min时两容器内均达到平衡状态,甲中c(C)=1.5 tool/L。请回答下列问题: 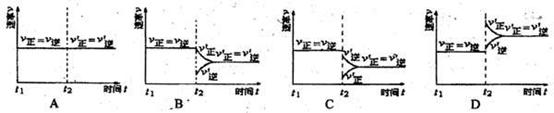
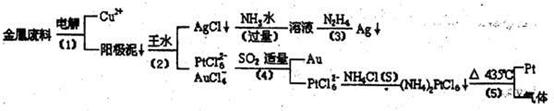
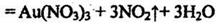 但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:
。
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:
。