23.下表为四种溶液的溶质质量分数和物质的量浓度的数值
|
溶液 |
KOH |
HNO3 |
CH3COOH |
HCl |
|
溶质质量分数ω(%) |
56 |
63 |
60 |
36.5 |
|
物质的量浓度c(mol/L) |
14.3 |
13.8 |
10.6 |
11.8 |
根据表中数据判断上述四种溶液中的密度最小的是
A.HCl B.HNO3 C.CH3COOH D.KOH
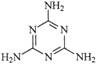 C.三鹿毒奶粉中的三聚氰胺是一种“伪蛋白”,其分子结构如右图所
C.三鹿毒奶粉中的三聚氰胺是一种“伪蛋白”,其分子结构如右图所 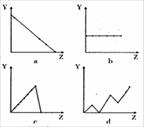 ① IIA 族元素的最外层电子数___________
① IIA 族元素的最外层电子数___________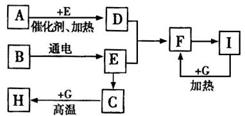
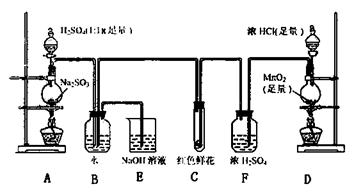 28.(20分)(一) 某学生为了测定部分变质的Na2SO3样品的纯度,设计了如下实验:
28.(20分)(一) 某学生为了测定部分变质的Na2SO3样品的纯度,设计了如下实验: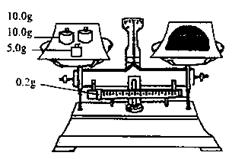 (3)C中的现象是
,E装置的作用是
。
(3)C中的现象是
,E装置的作用是
。