29. (13分)自然界中存在的天然纯碱主要来自于碱湖和固体碱矿。工业上以氯化钠为原料生产纯碱。
我国化工专家侯德榜发明的侯氏制碱法的原理是将二氧化碳通入氨水的氯化钠饱和溶液中,使碳酸氢钠从溶液中析出,过滤得到碳酸氢钠晶体。(已知氯化钠、碳酸氢钠、碳酸氢铵在20℃下的溶解度分别为:36g、9.6g、21.7g)侯氏制碱法的流程如下图:

(1)请写出制取碳酸氢钠的化学方程式: ,碳酸氢钠能从溶液中析出的原因是: 。
(2)侯氏制碱法的原理是将二氧化碳通入氨水的氯化钠饱和溶液中,能否将其改为“将氨水通入到二氧化碳的氯化钠饱和溶液”呢? (填“能”、“不能”)你选择的理由是: 。
(3)将析出的碳酸氢钠晶体煅烧,分解得到碳酸钠。写出该反应的化学方程式: 。
(4)在滤出碳酸氢钠后的母液中加入石灰水,生成的氨可以重新利用,写出发生反应的化学方程式: 。反应的另一产物氯化钙被弃掉,母液中食盐的利用率只有70%。侯德榜先生经过多年的摸索和实践,在过滤出碳酸氢钠后的母液中,不加石灰水,而是在降温到t℃后加食盐,利用低温下氯化铵比氯化钠溶解度小的特点,加入的食盐在连续循环操作中不断被利用,使食盐的利用率提高到96%。同时,析出的氯化铵又可作为化学肥料。请根据下表所给有关溶解度的数据,推测温度t应在 左右。
|
|
0℃ |
10℃ |
20℃ |
30℃ |
|
NaCl |
35.7
g |
35.8
g |
36.0
g |
36.3
g |
|
NH4Cl |
29.4
g |
33.3
g |
37.2
g |
41.4
g |
28. (9分)1L某混合溶液,可能含有的离子如下表:
|
可能大量含有的阳离子 |
Fe3+、H+、NH4+、Al3+、K+ |
|
可能大量含有的阴离子 |
Cl-、Br-、I-、ClO-、AlO2- |
(1)
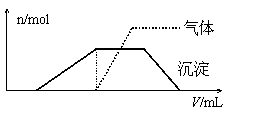 往该溶液中逐滴加入NaOH溶液并适当
往该溶液中逐滴加入NaOH溶液并适当
加热,产生沉淀和气体的物质的量(n)与加
入NaOH溶液的体积(V)关系如图所示。
不能确定是否含有的阳离子有 ,
要确定其存在可补充做实验的是 ;肯定不存在的阴离子有 。
(2)经检测,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
|
Cl2的体积(标准状况) |
2.8L |
5.6L |
11.2L |
|
n (Cl-) |
1.25 mol |
1.5 mol |
2 mol |
|
n(Br-) |
1.5 mol |
1.4 mol |
0.9 mol |
|
n(I-) |
a mol |
0 mol |
0 mol |
①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为
。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为 。
 各物质相互转化关系如下图所示:
各物质相互转化关系如下图所示: 2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是( )
2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是( )  现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中
现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中