16.拟用下图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;。、b、c、d表示相应仪器中加入的试剂)。
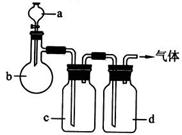
|
气体 |
a |
b |
c |
d |
|
C2H4 |
乙醇 |
浓H2SO4 |
NaOH溶液 |
浓H2SO4 |
|
C12 |
浓盐酸 |
MnO2 |
NaOH溶液 |
浓H2SO4 |
|
NH3 |
饱和NH4C1溶液 |
消石灰 |
H2O |
固体NaOH |
|
NO |
稀HNO3 |
铜屑 |
H2O |
P2O5 |
(1)上述方法中可以得到干燥、纯净的气体是 。
(2)指出不能用上述方法制取的气体,并说明理由(可以不填满) 。
①气体 ,理由是 。 ②气体--,理由是 。
③气体 ,理由是 。 ④气体--,理由是 。
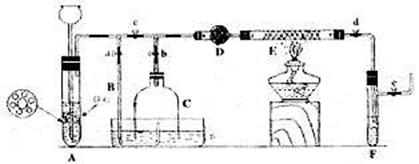
10. 图所示的装置制取氢气,在塑料隔板上放粗锌粒.漏斗和带支管的试管中装有稀硫酸,若打开弹簧夹。则酸液由漏斗流下,试管中液面上升与锌粒接触,发生反应,产生的氢气由支管导出;若关闭弹簧夹,则试管中液面下降,漏斗中液面上升,酸液与锌粒脱离接触.反应自行停止。需要时再打开弹簧夹,又可以使氢气发生。这是一种仅适用于室温下随制随停的气体发生装置。回答下面问题:
图所示的装置制取氢气,在塑料隔板上放粗锌粒.漏斗和带支管的试管中装有稀硫酸,若打开弹簧夹。则酸液由漏斗流下,试管中液面上升与锌粒接触,发生反应,产生的氢气由支管导出;若关闭弹簧夹,则试管中液面下降,漏斗中液面上升,酸液与锌粒脱离接触.反应自行停止。需要时再打开弹簧夹,又可以使氢气发生。这是一种仅适用于室温下随制随停的气体发生装置。回答下面问题:
(1)为什么关闭弹簧夹时试管中液面会下降?
(2)这种制气装置在加入反应物前,怎样检查装置的气密性?
(3)从下面三个反应中选择一个可以用这种随制随停的制气装
置制取的气体,填写下表中的空白。
①大理石与盐酸反应制取二氧化碳 ②黄铁矿与盐酸反应制取
硫化氢 ③用二氧化锰催化分解过氧化氢制氧气
|
气体名称 |
收集方法
|
检查方法 |
|
|
|
|
(4)食盐跟浓硫酸反应制氯化氢不能用这种装置随制随停。试说明理由。