11. (2009·安徽理综,28)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好
pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该
方法降解有机污染物pCP,探究有关因素对该降解反应速率的影响。
实验设计 控制pCP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。
|
实验 编号 |
实验目的 |
T/K |
pH |
c/10-3 mol·L-1 |
|
|
H2O2 |
Fe2+ |
||||
|
① |
为以下实验作参照 |
298 |
3 |
6.0 |
0.30 |
|
② |
探究温度对降解反应速率的影响 |
|
|
|
|
|
③ |
|
298 |
10 |
6.0 |
0.30 |

数据处理 实验测得pCP的浓度随时间变化的关系如上图。
(2)请根据上图实验①曲线,计算降解反应50-150 s内的反应速率:
v(pCP)=________mol·L-1·s-1。
解释与结论
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:________________________________________________________________________。
(4)实验③得出的结论是:pH等于10时,_______________________________。
思考与交流
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:________。
解析:(1)由题意可知实验①是参照实验,所以与实验①相比,实验②和③只能改变一个条件,这样才能起到对比实验的目的,则实验②是探究温度对反应速率的影响,则T=313 K,pH=3,c(H2O2)=6.0 mol·L-1,c(Fe2+)=0.30 mol·L-1,实验③是探究pH的大小对反应速率的影响;
(2)实验①曲线中,50-150 s内。
Δc(pCP)=1.2×10-3 mol·L-1-0.4×10-3 mol·L-1=0.8×10-3 mol·L-1,
所以V(pCP)==8.0×10-6 mol·L-1·s-1。
(3)在降解反应中,H2O2新产生的自由基起氧化作用,温度过高,H2O2因热稳定性差而分解,导致降解反应速率下降。
(4)由双曲线③可知,pH=10时,c(pCP)基本不变,反应趋于停止。
(5)由(4)得到启示:在pH=10溶液中,反应速率趋于零,可将所取样加入NaOH溶液中(使pH=10)反应停止。
答案:(1)
|
实验 编号 |
实验目的 |
T/K |
pH |
c/10-3 mol·L-1 |
|
|
H2O2 |
Fe2+ |
||||
|
① |
|
|
|
|
|
|
② |
|
313 |
3 |
6.0 |
0.30 |
|
③ |
探究溶液的pH对降解反应速率的影响 |
|
|
|
|
(2)8.0×10-6 (3)过氧化氢在温度过高时迅速分解 (4)反应速率趋向于零(或该降解反应趋于停止) (5)将所取样品迅速加入到一定量的NaOH溶液中,使pH约为10(或将所取样品骤冷等其他合理答案均可)
9.在相同条件下进行Mg与HCl、CH3COOH反应的对照实验,相关数据如下:
|
|
Mg的质量 |
酸 量 |
开始时反应速率 |
产生H2总量 |
|
Ⅰ |
0.24
g |
HCl 0.2 mol/L 100 mL |
v1 |
n1 |
|
Ⅱ |
0.24
g |
CH3COOH 0.2 mol/L 100
mL |
v2 |
n2 |
(1)试比较有关量的大小:v1____v2,n1____n2(填“>”、“=”或“<”)
(2)现欲改变条件,使实验Ⅰ中v1降低,但不改变n1的值,试写出两种可行的方法。
方法Ⅰ_____________________________________________。
方法Ⅱ_____________________________________________。
解析:(1)n(Mg)==0.01 mol,n(HCl)=n(CH3COOH)=0.2 mol/L×0.1 L=0.02 mol,因此Mg与HCl、CH3COOH分别反应时,均能恰好完全反应,生成H2总量相同,n1=n2;反应开始时,HCl中c(H+)大于CH3COOH中c(H+),由于c(H+)越大,反应速率越快,所以反应开始时,v1>v2。
(2)改变条件使实验Ⅰ中v1降低,n1不变,需满足c(H+)降低,n(H+)保持不变,因此可采取向HCl中加水稀释或降低温度,或加入CH3COONa固体等方法。
答案:(1)> =(2)加少量水 降温或加少量CH3COONa固体
8. (2009·全国Ⅱ,27)某温度时,在2 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如下表所示。
(1)根据下表中数据,画出X、Y、Z的物质的量(n)随时间(t)变化的曲线。
|
t/min |
X/mol |
Y/mol |
Z/mol |
|
0 |
1.00 |
1.00 |
0.00 |
|
1 |
0.90 |
0.80 |
0.20 |
|
3 |
0.75 |
0.50 |
0.50 |
|
5 |
0.65 |
0.30 |
0.70 |
|
9 |
0.55 |
0.10 |
0.90 |
|
10 |
0.55 |
0.10 |
0.90 |
|
14 |
0.55 |
0.10 |
0.90 |
(2)体系中发生反应的化学方程式是_________________________________;
(3)列式计算该反应在0-3 min时间内产物Z的平均反应速率:________________;
(4)该反应达到平衡时反应物X的转化率α等于________;
(5)如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z的物质的量随时间变化的曲线①、②、③(如图所示),

则曲线①、②、③所对应的实验条件改变分别是:
①______________,②______________,③______________。
答案:(1)

(2)X(g)+2Y(g) 2Z(g)
2Z(g)
(3)=0.083 mol·L-1·min-1
(4)45% (5)①升高温度 ②加入催化剂 ③增大压强

 2C(g) ΔH>0速率图像如图所示。导致t′时刻的速率图线变 化的原因可能是( )
2C(g) ΔH>0速率图像如图所示。导致t′时刻的速率图线变 化的原因可能是( )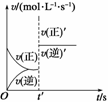

 pC(g),改变温度(其他条件不变)、压强(其他条件不变)、对上述反应正逆反应速率的影响分别如图所示,以下叙述正确的是( )
pC(g),改变温度(其他条件不变)、压强(其他条件不变)、对上述反应正逆反应速率的影响分别如图所示,以下叙述正确的是( )
 2NH3,2
min时测得剩余N2为1
mol,下列表示其化学反应速率正确的是( )
2NH3,2
min时测得剩余N2为1
mol,下列表示其化学反应速率正确的是( ) 2NH3
2NH3