2.(2009·广东单科,21)三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:浓硫酸、1.0 mol·L-1 HNO3溶液、1.0 mol·L-1盐酸、1.0 mol·L-1 NaOH溶液、3%H2O2溶液、0.1 mol·L-1 KI溶液、0.1 mol·L-1 CuSO4溶液、20% KSCN溶液、澄清石灰水、氧化铜、蒸馏水。
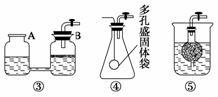
(1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C),观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是________。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是________,现象是________________________________________________________________________。
(3)固体产物中铁元素存在形式的探究。
①提出合理假设
假设1:__________________________________________________________________;
假设2:___________________________________________________________________;
假设3:________________________________________________________________。
②设计实验方案证明你的假设
③实验过程
根据②中方案进行实验。按下表的格式写出实验步骤、预期现象与结论。
|
实验步骤 |
预期现象与结论 |
|
步骤1: |
|
|
步骤2: |
|
|
步骤3: |
|
|
…… |
|
解析:(1)根据A中石灰水变浑浊,知有CO2气体,B中有红色固体生成,说明CuO被还原,C中石灰水变浑浊,可知B中CuO被CO还原。
(3)因为题目中说明铁不以三价存在,只能是以二价铁或单质形式,或两者混合物存在。
步骤1:利用K2CO3的溶解性,除去K2CO3;
步骤2:利用铁能置换出Cu,而FeO不能置换出Cu来检验是否含铁单质;
步骤3:利用盐酸酸化分离出FeO,再用H2O2氧化,利用KSCN是否变色,来验证固体中是否含FeO。
答案:(1)CO和CO2 (2)焰色反应 透过蓝色钴玻璃观察到紫色火焰 (3)①全部为铁单质 全部为FeO 同时存在铁单质和FeO
③
|
实验步骤 |
预期现象与结论 |
|
步骤1:取适量固体产物于试管中,加入足量蒸馏水,充分振荡使K2CO3完全溶解。分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体。 |
固体产物部分溶解。 |
|
步骤2:向试管中加入适量CuSO4溶液,再加入少量上述不溶固体,充分振荡。 |
(1)若蓝色溶液颜色及加入的不溶固体无明显变化,则假设2成立。 (2)若蓝色溶液颜色明显改变,且有暗红色固体物质生成,则证明有铁单质存在。 |
|
步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色。取少量固体于试管中,滴加过量HCl后,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN。 |
结合步骤2中的(2); (1)若溶液基本无色,则假设1成立。 (2)若溶液呈血红色,则假设3成立。 |
18.某学生用托盘天平称量一只小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在刻度盘的偏右位置,此时左边的托盘将________(填“高于”或“低于”)右边的托盘,欲使天平平衡,所进行的操作应为____________。假定最终称得小烧杯的质量为________(填“32.6 g”或“32.61 g”),请用“↓”表示在托盘上放上砝码,“↑”表示从托盘上取下砝码的称量过程,并在标尺上画出游码位置(画表示图)。
|
砝码质量/g |
50 |
20 |
20 |
10 |
5 |
|
称量(取用砝码)过程 |
|
|
|
|
|

假使砝码与物体放错位置,得物质为________g。
解析:本题考查天平的使用。中间指针偏向右边,则左边托盘高于右边托盘,若要使左边托盘下降,应向左边调节平衡螺母。由于天平称量质量的精确度为0.1 g,则数据为32.6 g。根据游码标尺和砝码种类,游码为2.6 g,砝码可为一个20 g和一个10 g的组合。假设放错位置,则有关系:m砝码=m物+m游砝,物质的质量为:30 g-2.6 g=27.4 g。
答案:高于 向左边调节平衡螺母 32.6 g
|
砝码质量/g |
50 |
20 |
20 |
10 |
5 |
|
称量(取用砝码)过程 |
↓↑ |
↓ |
↓↑ |
↓ |
↓↑ |

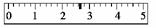 4
4