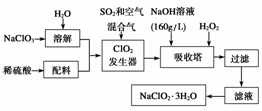
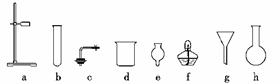
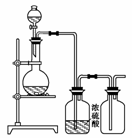
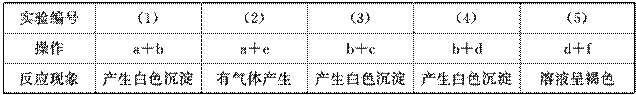1.(2009·重庆理综,6)材料与化学密切相关,表中对应关系错误的是( )
|
选项 |
材 料 |
主要化学成分 |
|
A |
刚玉、金刚石 |
三氧化二铝 |
|
B |
大理石、石灰石 |
碳酸钙 |
|
C |
普通水泥、普通玻璃 |
硅酸盐 |
|
D |
沙子、石英 |
二氧化硅 |
解析:A项,刚玉的主要化学成分为三氧化二铝,而金刚石的主要化学成分为碳。
答案:A
16.(2008·四川理综,26)某固体混合物可能含有MgCO3、Al2(SO4)3、Na2SO4、Ba(NO3)2、AgNO3和CuSO4。将该混合物进行如下实验,根据所给实验现象完成表格(对于能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”)。
(1)将少许混合物放入水中得到无色溶液和白色沉淀。
|
肯定存在的物质 |
肯定不存在的物质 |
理 由 |
|
|
|
|
(2)取溶液进行焰色反应,火焰呈黄色。
|
肯定存在的物质 |
肯定不存在的物质 |
理 由 |
|
|
|
|
(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。
|
肯定存在的物质 |
肯定不存在的物质 |
理 由 |
|
|
|
|
(4)通过上述实验仍无法确定的物质是________________________________________________________________________。
解析:(1)根据无色溶液,可判断一定无CuSO4,因为CuSO4溶液为蓝色。
(2)根据焰色反应呈黄色,则判断一定有Na2SO4,不能确定其他的物质是否存在。
(3)与盐酸反应放出气体,且沉淀完全溶解,因此一定有MgCO3,一定无Ba(NO3)2和AgNO3,若有这两种物质,会生成不溶于盐酸的沉淀。
答案:(1)
|
无 |
CuSO4 |
溶液无色,而CuSO4溶液为蓝色 |
(2)
|
Na2SO4 |
无 |
钠的焰色反应呈黄色 |
(3)
|
MgCO3 |
Ba(NO3)2、 AgNO3 |
MgCO3沉淀溶于稀盐酸,有气体放出;如有Ba(NO3)2,生成的BaSO4沉淀不溶于盐酸;如有AgNO3,生成的沉淀在盐酸中不消失 |
(4)Al2(SO4)3
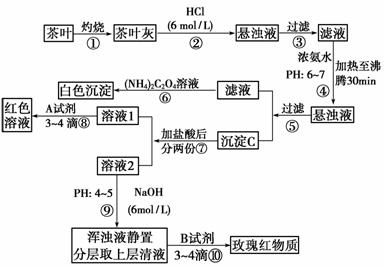 H)3:pH≥4.1。
H)3:pH≥4.1。  (2)Ca2+?+(NH4)2C2O4 CaC2O4↓+2NH+4
(2)Ca2+?+(NH4)2C2O4 CaC2O4↓+2NH+4  (4)Fe3++3SCN-
Fe(SCN)3
(4)Fe3++3SCN-
Fe(SCN)3 根据②的实验方案,进行实验。请按下表格式写出实验操作步骤、预期现象与结论。
根据②的实验方案,进行实验。请按下表格式写出实验操作步骤、预期现象与结论。  催化剂中铁元素同时存在+2价与+3价
催化剂中铁元素同时存在+2价与+3价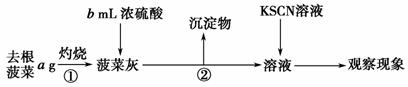 Ⅰ.
Ⅰ.  (4)通过步骤Ⅲ可以确定菠菜中含有草酸类物质。由于滤液中含有 ,故需加入试剂
(4)通过步骤Ⅲ可以确定菠菜中含有草酸类物质。由于滤液中含有 ,故需加入试剂