为提高酸碱中和滴定测定结果的准确性,必须准确测定参加反应的两种溶液的体积,并准确判断中和反应是否恰好进行完全。具体应从以下几个方面突破。
1、指示剂的选择
滴定时选用的指示剂一般有酚酞和甲基橙,石蕊试液由于变色不明显,在滴定时不宜使用。
选择原则:指示剂的颜色变化灵敏,变色范围最好接近等当点(化学计量点)。
常用选择:
|
滴定类别 |
选择的指示剂 |
选择理由 |
|
强碱滴定强酸 |
酚酞 |
在滴定终点时浅色变成深色更易于观察 |
|
强酸滴定强碱 |
甲基橙 |
在滴定终点时浅色变成深色更易于观察 |
|
强酸滴定弱碱 |
甲基橙 |
生成的盐水解呈酸性,甲基橙的变色范围为3.1-4.4,落在酸性范围之内。 |
|
强碱滴定弱酸 |
酚酞 |
生成的盐水解呈碱性,酚酞的变色范围为8-10,落在碱性范围之内。 |
需要指出的是滴定所用的指示剂的用量一般为2滴,不能太多或太少。因为酸碱指示剂属于有机酸或有机碱,指示剂也参加反应,在变色过程中消耗标准溶液。若指示剂用量太多,则消耗掉的标准溶液也有所增多,会导致误差;若指示剂用量太少,其颜色变化不明显,致使终点提前或延迟,使实验误差增大。
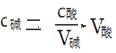
 。关于它的说法正确的是( )
。关于它的说法正确的是( )
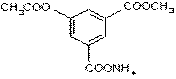 与足量NaOH溶液充分反应,消耗NaOH的物质的量是( )
与足量NaOH溶液充分反应,消耗NaOH的物质的量是( )