7.a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
|
微粒代码 |
a |
b |
c |
d |
e |
f |
g |
|
原子核数 |
单核 |
单核 |
双核 |
多核 |
单核 |
多核 |
多核 |
|
带电荷数(单位电荷) |
0 |
1+ |
1- |
0 |
2+ |
1+ |
0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。
试写出:
(1)a微粒的电子式________________;
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为________>________(用化学式表示);
(3)d的结构简式________________;
(4)g微粒所属化合物类型________,是________分子(填“极性”或“非极性”);
(5)用化学式表示:c微粒是________;f微粒是________。
解析:10电子的微粒有:原子Ne;分子CH4、NH3、H2O、HF(均为第二周期非金属元素的气态氢化物);简单阳离子Na+、Mg2+、Al3+(均为第三周期金属元素形成的阳离子);复杂阳离子H3O+、NH;简单阴离子N3-、O2-(以上两种离子不能在水溶液中稳定存在)、F-;复杂阴离子OH-。
可知:a为Ne;b为Na+;c为OH-;d为NH3;e为Mg2+;f为H3O+(H3O++OH-===2H2O);g为H2O。
答案:(1)···· (2)NaOH Mg(OH)2 (3)
 (4)共价化合物 极性
(4)共价化合物 极性
(5)OH- H3O+
6.如图为元素周期表的一部分。X、Y、Z、W均为短周期元素,若W原子的最外层电子数是其次外层电子数的7/8。则下列说法中正确的是( )
|
X |
Y |
|
|
|
Z |
W |
A.Y单质可与Z的氢化物的水溶液反应,使溶液pH升高
B.最高价氧化物的水化物酸性:W>Z
C.原子半径由大到小的排列顺序是Z>Y>X
D.X的单质中有一种为白色蜡状固体
解析:由W的原子结构特点可推知W为氯元素,则依它们在元素周期表中的位置关系可知X、Y、Z依次为氮元素、氧元素和硫元素。A中的反应是2H2S+O2===2S↓+2H2O,A正确;HClO4酸性强于H2SO4,B正确;X、Y、Z的原子半径应是Z>X>Y,C不对;N元素的单质为无色气体,D不对。
答案:AB
5. 已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,错误的是( )
|
元素 |
I1 |
I2 |
I3 |
I4 |
|
X |
500 |
4 600 |
6 900 |
9 500 |
|
Y |
580 |
1 800 |
2 700 |
11 600 |
A . 元素X的常见化合价是+1
B.元素Y是ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应
解析:X的第一电离能(I1)显著小于I2、I3等,可知X最外层只有一个电子,故常见化合价为+1价,且与Cl元素形成XCl,A、C两项正确;Y元素的I1、I2、I3相差不悬殊,与I4悬殊明显,故Y最外层有3个电子,为ⅢA族元素,当n=3时,Y为Al,与冷水不反应,故B正确,而D错误。
答案:D
 HCN+OH-。
HCN+OH-。 HCN+OH- (5)16w1∶(44w2-aw1)
HCN+OH- (5)16w1∶(44w2-aw1)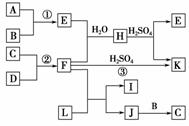
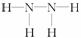 )。
)。
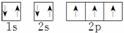 ,可见该元素核外有7个电子,为氮元素,其元素符号为N。
,可见该元素核外有7个电子,为氮元素,其元素符号为N。