22.现有a mol由H2和Cl2组成的混合气体,使之在适宜条件下充分反应后,用足量的NaOH
溶液吸收反应后残余气体,消耗b mol NaOH。试解答下列问题:
(1)通过计算,将计算结果填入下表:
|
|
H2和Cl2物质的量的关系 |
生成NaCl的物质的量 |
|
① |
n(H2)=n(Cl2) |
|
|
② |
n(H2)>n(Cl2) |
|
(2)推断当n(H2)<n(Cl2)时,生成NaCl的物质的量________。
解析:(1)当n(H2)=n(Cl2)和n(H2)>n(Cl2)时,仅发生反应H2+Cl2===2HCl和HCl+
NaOH===NaCl+H2O,且Cl2完全反应,据Cl2的多少计算,n(H2)=n(Cl2)时得NaCl a
mol(或b mol),n(H2)>n(Cl2)时得NaCl b mol。
(2)设H2的物质的量为x mol,则n(Cl2)=(a-x) mol。
H2+Cl2===2HCl
x mol x mol 2x mol
HCl+NaOH===NaCl+H2O
2x mol 2x mol
Cl2(余)+2NaOH===NaCl+NaClO+H2O
(a-x) mol-x mol (a-2x) mol
共生成NaCl:2x mol+(a-2x) mol=a mol
答案:(1)
|
|
H2和Cl2物质的量的关系 |
生成NaCl的物质的量 |
|
① |
n(H2)=n(Cl2) |
a
mol或b
mol |
|
② |
n(H2)>n(Cl2) |
b
mol |
(2)a mol
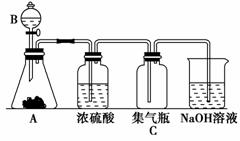
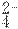 工业上制备单质碘的方法之一是从碘酸盐开始的。第一步先用适量的亚硫酸氢盐将碘
工业上制备单质碘的方法之一是从碘酸盐开始的。第一步先用适量的亚硫酸氢盐将碘 I2,由题给信息及(1)中反应知,碘酸盐在第一步和第二步反应中用量之比为5∶1。
I2,由题给信息及(1)中反应知,碘酸盐在第一步和第二步反应中用量之比为5∶1。
 A.HCN-
H++CN-
A.HCN-
H++CN-