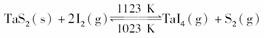20.(2009·上海高考)在2
L密闭容器内,800℃时反应2NO(g)+O2(g)
 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=__________。已知:K300℃>K350℃,则该反应是__________________热反应。
(2)如图中表示NO2变化曲线的是__________________。用O2表示从0 s-2 s内该反应的平均速率v=__________。

(3)能说明该反应已达到平衡状态的是__________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
解析:(1)由300℃-350℃时,K值减小,说明升温平衡左移,逆反应为吸热反应,则正反应是放热反应。
(2)由平衡体系2NO(g)+O2(g)
 2NO2(g)知,NO2为生成物,在0
s时,c(NO2)=0
mol/L,随反应的进行,c(NO2)逐渐增大,当达到平衡时,c(NO2)=-=0.0065
mol/L,故表示NO2变化曲线的为b。v(NO)===
2NO2(g)知,NO2为生成物,在0
s时,c(NO2)=0
mol/L,随反应的进行,c(NO2)逐渐增大,当达到平衡时,c(NO2)=-=0.0065
mol/L,故表示NO2变化曲线的为b。v(NO)===
=0.003 mol/(L·s)
则v(O2)=v(NO)
=0.0015 mol/(L·s)
(3)a项中未指明正、逆反应速率,故无法说明该反应是否达到平衡状态;由于该反应是反应前后气体体积不相等的反应,当容器内压强保持不变时,说明该反应已达到平衡状态,故b项正确;c项中已说明正、逆反应速率相等,故说明该反应已达到平衡状态;由于气体总质量不变,气体总体积也不变,因此,无论该反应是否达到平衡状态,容器内密度总保持不变,故d项无法说明该反应是否达到平衡状态。
(4)a项能使反应速率减慢,平衡正移,故a项错误;b项能使反应速率加快,平衡逆移,故b项错误;c项能使反应速率加快,平衡正移,故c项正确;d项能使反应速率加快,但对平衡无影响,故d项错误。
答案:(1) 放
(2)b 1.5×10-3mol/(L·s)
(3)b、c (4)c