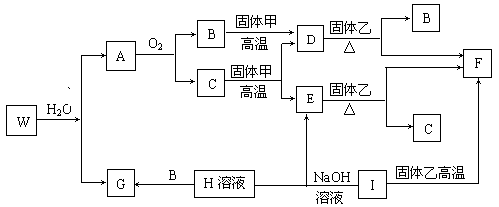
20.(10分)以下素材是某课外实验小组的实验记录,请根据实验记录回答有关问题。
实验内容:铜与硝酸反应有关问题的探讨
实验器材:电线细铜丝,1mol·L-1HNO3,14mol·L-1HNO3,碱石灰,玻璃丝,Cu(NO3)2晶体,酒精灯,试管,夹持器械,火柴。实验装置和记录如下:
|
步骤 |
实验操作 |
现象记录 |
|
1 |
将1 g细铜丝放入盛有10mL1mol·L-1HNO3的试管中加热 |
铜丝表面有无色气体逸出,溶液变成天蓝色 |
|
2 |
将1 g细铜丝放入盛有10mL14mol·L-1HNO3的试管中加热 |
产生大量红棕色气体,溶液变为绿色,绿色由深到浅,未见到蓝色 |
|
3 |
将硝酸铜晶体配成饱和溶液 |
深蓝色溶液 |
|
4 |
向饱和的硝酸铜溶液中不断滴加14mol·L-1HNO3 |
溶液仍呈深蓝色 |
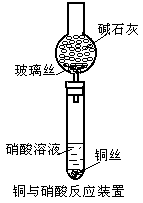 请回答:
请回答:
(1)稀硝酸与铜丝反应后,所得溶液呈天蓝色的化学粒子符号是 (写化学式)
(2)使饱和硝酸铜溶液呈深蓝色的化学粒子符号可能是
。
(3)有资料上介绍浓硝酸与铜丝反应后所得溶液颜色显蓝色,实验中得到却是绿色溶液,试写出显绿色的可能原因
_______________________,设计两种不同的简单实验方法证明你的解释:
方案①
方案② 。
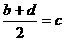 ,③
,③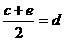 ,请根据提供的信息,回答下列问题(回答问题时,必须用具体元素符号代替A、B、C、D、E、G)。
,请根据提供的信息,回答下列问题(回答问题时,必须用具体元素符号代替A、B、C、D、E、G)。 (5)由(GC)4·G4C3+,其空间构型发生了很大变化。(GC)4是由半径小的C组成正方形,半径大的G构成正四面体,彼此互相穿插构成的笼状化合物;G4C3+是一种以异种原子相邻为主体的平面型阳离子,请分别画出(GC)4、G4C3+的结构示意图。
(5)由(GC)4·G4C3+,其空间构型发生了很大变化。(GC)4是由半径小的C组成正方形,半径大的G构成正四面体,彼此互相穿插构成的笼状化合物;G4C3+是一种以异种原子相邻为主体的平面型阳离子,请分别画出(GC)4、G4C3+的结构示意图。