网址:http://m.1010jiajiao.com/timu3_id_434034[举报]
某校化学实验小组同学进行有关NO2气体的系列实验。

(1)如上图所示,烧瓶中放有少量铜片,打开分液漏斗
的旋塞,加入过量浓硝酸,烧瓶中产生气体的颜色是 ,试管中收集的气体颜色是 ,用化学方程式表示其原因 ;
(2)将烧瓶浸入冰水中,烧瓶内气体颜色 (填“变深”、“不变”或“变浅”),使用化学用语和必要的文字说明颜色变化的原因 ;
(3)在80℃时,将0.40 mol N2O4气体充入2 L已经抽空的固定容积的密闭容器中发生反应,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4)/mol |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2)/mol |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
①计算a = ,此温度时该反应的平衡常数K= ;
②平衡后,向该容器中再充入0.2molN2O4气体,则N2O4的转化率 (填增大、减小或不变)
③改变条件使反应重新达到平衡,能使c(NO2)/c(N2O4)值变小的措施有(填序号) 。
A.增大N2O4的起始浓度 B.升高温度
C.使用高效催化剂 D.向混合气体中通入稀有气体
查看习题详情和答案>>
某校化学实验小组同学进行有关NO2气体的系列实验。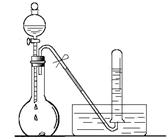
(1)如上图所示,烧瓶中放有少量铜片,打开分液漏斗的旋塞,加入过量浓硝酸,烧瓶中产生气体的颜色是 ,试管中收集的气体颜色是 ,用化学方程式表示其原因 ;
(2)将烧瓶浸入冰水中,烧瓶内气体颜色 (填“变深”、“不变”或“变浅”),使用化学用语和必要的文字说明颜色变化的原因 ;
(3)在80℃时,将0.40 mol N2O4气体充入2 L已经抽空的固定容积的密闭容器中发生反应,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4)/mol | 0.40 | a | 0.20 | c | d | e |
| n(NO2)/mol | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
②平衡后,向该容器中再充入0.2molN2O4气体,则N2O4的转化率 (填增大、减小或不变)
③改变条件使反应重新达到平衡,能使c(NO2)/c(N2O4)值变小的措施有(填序号) 。
A.增大N2O4的起始浓度 B.升高温度
C.使用高效催化剂 D.向混合气体中通入稀有气体 查看习题详情和答案>>
某校化学实验小组同学进行有关NO2气体的系列实验。
(1)如上图所示,烧瓶中放有少量铜片,打开分液漏斗
的旋塞,加入过量浓硝酸,烧瓶中产生气体的颜色是 ,试管中收集的气体颜色是 ,用化学方程式表示其原因 ;
(2)将烧瓶浸入冰水中,烧瓶内气体颜色 (填“变深”、“不变”或“变浅”),使用化学用语和必要的文字说明颜色变化的原因 ;
(3)在80℃时,将0.40 mol N2O4气体充入2 L已经抽空的固定容积的密闭容器中发生反应,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4)/mol | 0.40 | a | 0.20 | c | d | e |
| n(NO2)/mol | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
①计算a = ,此温度时该反应的平衡常数K= ;
②平衡后,向该容器中再充入0.2molN2O4气体,则N2O4的转化率 (填增大、减小或不变)
③改变条件使反应重新达到平衡,能使c(NO2)/c(N2O4)值变小的措施有(填序号) 。
A.增大N2O4的起始浓度 B.升高温度
C.使用高效催化剂 D.向混合气体中通入稀有气体
查看习题详情和答案>>
(1)上述实验过程中发生的反应有(用离子方程式表示):
①Fe2O3+6H+=2Fe3++3H2O ②
(2)若实验中观察到溶液变为蓝色且有固体剩余,则n(Cu2O)
( II)分别在密闭容器的两个反应室中进行如下反应:
左反应室:A(g)+2B(g)
| 常温 |
右反应室:2Z(g)
| 常温 |
在反应室之间有无摩擦、可自由滑动的密封板隔断.反应开始和达到平衡时有关物理量的变化如图所示:

(1)A(g)+2B(g 2C(g) 的△H
(2)在平衡(I)和平衡(Ⅱ)中,X的体积分数
a.一定相等 b.一定不相等 c.可能相等
(3)达到平衡(I)时,A的转化率为
| 5 |
| 11 |
| 5 |
| 11 |