19.(14分)工业上生产硫酸时,通过煅烧黄铁矿得SO2,利用催化氧化反应将SO2转化为SO3,SO3被吸收得硫酸。
(1)判断制硫酸的下列说法正确的是(选填字母序号) 。
a.为使铁矿充分燃烧,需将其粉碎 b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率,增大反应热。
d.沸腾炉排出的矿渣可供炼铁
(2)将SO2转化为SO3是一个关键步骤。压强及温度对SO2的转化率的影响如下表(原料气各成分的体积分数为:SO2 7% ,O2 11% ,N2 82%)
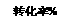
|
|

①SO2氧化成SO3的化学方程式为 ,由表中数据可知该反应为_________反应(填“放热”或“吸热”)。
②在400-5000C时,SO2的催化氧化采用常压而不是高压,主要原因是_________________
(3)为提高SO3的吸收率,减少酸雾,实际生产上用____________吸收SO3 。
(4)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2 吸收Br2的离子方程式是 。
(5)若以含硫40%的黄铁矿100t生产硫酸,若整个过程中硫的综合利用率为80%,则可生产98%的浓硫酸多少t?
《物质结构与性质》模块:
14. (7分)氮是地球上含量丰富的一种元素,
(7分)氮是地球上含量丰富的一种元素,
氮及其化合物在工农业生产、生活中有着重要
作用。请回答:
(1)右图是 1 molNO2和 1 molCO反应生成CO2
和NO过程中能量变化示意图,则NO2和CO反应
的热化学方程式为:_____________ ______
(2)在一定体积的密闭容器中,进行反应: N2(g)+ 3H2(g) 2NH3(g);△H<0,
2NH3(g);△H<0,
其化学平衡常数K与温度T的关系如下表,请按要求填空:
|
T/K |
298 |
398 |
498 |
… |
|
K/(
mol·L-1)-2 |
4.1
x 106 |
K1 |
K2 |
… |
①比较K1 、K2的大小:K1 ______ K2 (填“>”、“=”或“<”)
②判断该反应达到化学平衡状态的依据是_______(填序号)
A.2 V(H2.正) = 3 V(NH3.逆) B.3molH-H键断裂的同时,有6molN-H键形成
C.容器内的压强保持不变 D.混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,其水解原理与NH4Cl相似,但其分两步水解。则盐酸肼第一步水解的离子方程为_________ 。
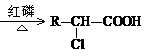
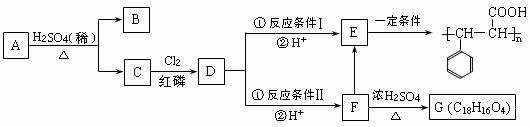

 甲型H1N1流感疫情已对人类健康构成威胁。目前治疗人类“甲流”的有效药物“达菲”其合成原料是我国盛产的莽草酸。其结构简式可写成
, 有关莽草酸的叙述正确的是( )
甲型H1N1流感疫情已对人类健康构成威胁。目前治疗人类“甲流”的有效药物“达菲”其合成原料是我国盛产的莽草酸。其结构简式可写成
, 有关莽草酸的叙述正确的是( )