20、(8分)800℃时,在2L密闭容器内充入0.50molNO和0.25molO2 ,发生如下反应:
 2NO(g)+O2(g) 2NO2(g) △H<0。体系中,n(NO)随时间的变化如表:
2NO(g)+O2(g) 2NO2(g) △H<0。体系中,n(NO)随时间的变化如表:
|
t(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.50 |
0.35 |
0.28 |
0.25 |
0.25 |
0.25 |
(1)能说明该反应已达到平衡状态的是 。
A、v(NO2)正=v(O2)逆 B、容器内压强保持不变
C、v(NO)逆=2v(O2)正 D、容器内气体颜色不变
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的措施是 。
A、适当升高温度 B、缩小反应容器的体积
C、增大O2的浓度 D、选择高效催化剂
(3)计算800℃时该反应的平衡常数K。
(4)将上述反应进行到4s时的混合气体用足量的水吸收,为保证混合气体中NO、NO2全部转化为HNO3,计算还需通入的O2的体积(折算成标准状况)。
17、 (10分)工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-、和SO42-等杂质,提纯工艺线路如下:
(10分)工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-、和SO42-等杂质,提纯工艺线路如下:
Ⅰ、碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
 Na2CO3·10 H2O Na2CO3·7H2O Na2CO3·H2O
Na2CO3·10 H2O Na2CO3·7H2O Na2CO3·H2O
32 36 t(℃)
Ⅱ、有关物质的溶度积如下:
|
物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
Fe (OH)3 |
|
Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时发生的离子方程式为 。向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)= 。
(2)“趁热过滤”时的温度应控制在 。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。请你分析实际工业生产中是否可行 ,并说明理由 。
(4)已知:Na2CO3·10 H2O(s)=Na2CO3(s)+10 H2O(g) △H=+532.36kJ·mol-1
Na2CO3·10 H2O(s)=Na2CO3·H2O(s)+9 H2O(g) △H=+473.63kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式 。


 A.次氯酸的结构式为:H-Cl-O B.-OH与 都表示羟基
A.次氯酸的结构式为:H-Cl-O B.-OH与 都表示羟基




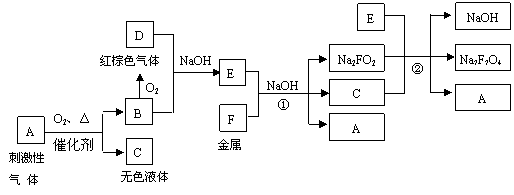 (10分)有下列物质之间的相互转化:
(10分)有下列物质之间的相互转化: