11.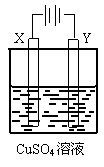 如右图所示,选用不同的电极材料电解硫酸铜溶液,下列说法正确的是
如右图所示,选用不同的电极材料电解硫酸铜溶液,下列说法正确的是
|
|
X电极 |
Y电极 |
通电后的变化 |
|
A |
石墨 |
石墨 |
Y电极质量增加,溶液的pH增大 |
|
B |
铁 |
铜 |
两电极的质量不发生变化 |
|
C |
铜 |
铁 |
X电极质量减小,Cu2+浓度不变 |
|
D |
铁 |
铂 |
Y电极:Fe2++2e-= Fe |
8. 从下列实验事实所得出的相应结论不正确的是
|
|
实 验
事 实 |
相 应 结 论 |
|
A |
给试管中某红色溶液加热,溶液颜色逐渐变深 |
原溶液可能是滴有酚酞的Na2CO3溶液 |
|
B |
某无色溶液中加入氢氧化钠浓溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝 |
该溶液含有NH4+ |
|
C |
配制0.5 mol/L NaCl溶液,定容时俯视容量瓶刻度线
|
溶液浓度偏高 |
|
D |
根据分散系是否具有丁达尔现象 |
区分溶液、胶体和浊液 |
 B.2008年8月8日,北京奥运会开幕式上的绚丽焰火是焰色反应的见证
B.2008年8月8日,北京奥运会开幕式上的绚丽焰火是焰色反应的见证
 xC(g),平衡时两容器中A、B、C的物质的量之比均为1:3:6。下列说法一定正确的是 (
)
xC(g),平衡时两容器中A、B、C的物质的量之比均为1:3:6。下列说法一定正确的是 (
)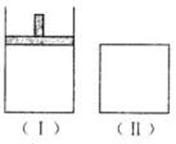 A.x的值为3
A.x的值为3