1.用如右图表示的一些物质或概念间的从属关系中不正确的是 ( )
|
|
X |
Y |
 Z Z |
|
A |
氧化物 |
化合物 |
纯净物 |
|
B |
离子化合物 |
电解质 |
化合物 |
|
C |
胶体 |
分散系 |
混合物 |
|
D |
非金属氧化物 |
酸性氧化物 |
氧化物 |
18.本题包括2个小题,共20分。复分解反应是中学化学中常
见的一种反应类型。
(1)已知在常温下,测得浓度均为0.1mol/L的下列六种溶液的pH:
|
溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
|
pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
复分解反应存在这样一个规律:一种较强酸与一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑
若换个角度看,它同时还揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请你判断下列反应不能成立的是 (填编号)。
A.CO2+H2O+2NaClO=Na2CO3+2HClO
B.CO2+H2O+NaClO=NaHCO3+HClO
C.CO2+H2O+C6H5ONa→NaHCO3+C6H5OH
D.CO2+H2O+2C6H5ONa→Na2CO3+2C6H5OH
E.CH3COOH+NaCN=CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05mol/L的下列六种物质的溶液中,pH最小的是
(填编号),其pH为 (填数值);pH最大的是 (填编号);
①HClO4 ②CH3COOH ③HCN ④HClO ⑤H2SO4
(3)一些复分解反应的发生还遵循其他的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②工业上将石灰乳与苦卤(主要溶质KCl、MgCl2)混合可得氢氧化镁固体
③蒸馏KCl和NaNO3混合溶液,首先析出NaCl晶体
请根据上述反应,总结出复分解反应发生的另一个规律:
。
将KI溶液与AgCl固体混合搅拌,固体变为黄色。该反应也遵循这一规律,请写出反应的化学方程式: 。
II.(10分)设计出燃料电池使汽油氧化直接产生电流是对21世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。回答如下问题:
(1)以庚烷(C7H16)代表汽油,这个电池放电时发生的化学反应的化学方程式是:
(2)这个电池的负极发生的反应是:C7H16+22O2--44e-=7CO2+8H2O
正极发生的反应是:
固体电解质里的O2-向 极移动
(3)人们追求燃料电池氧化汽油而不在内燃机里燃烧汽油产生动力的主要原因是:
(4)汽油燃料电池最大的障碍是氧化反应不完全产生 堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年时间,正是新一代化学家的历史使命。
 TiO2、
TiO2、 TiO2、、
TiO2、、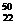 TiO2互为同位素
TiO2互为同位素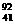 Nb3+原子核内有51个中子,核外有41个电子
Nb3+原子核内有51个中子,核外有41个电子
 N2(g)+3H2(g)
2NH3(g) △H=-92.4kJ/mol
N2(g)+3H2(g)
2NH3(g) △H=-92.4kJ/mol ,在相同容器中,降低温度,并且开始时通入2mol氨气和1mol氢气及固体催化剂,反应达到平衡时氨气的体积分数,下列判断正确的是 (填序号)
,在相同容器中,降低温度,并且开始时通入2mol氨气和1mol氢气及固体催化剂,反应达到平衡时氨气的体积分数,下列判断正确的是 (填序号)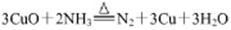


 II.(6分)已知物质M由同一短周期的X、Y两种元素组成,X原子的最外层电子数是最内层电子数的
II.(6分)已知物质M由同一短周期的X、Y两种元素组成,X原子的最外层电子数是最内层电子数的 ,Y元素最高正价与它的负价代数和为6。M与其它物质的转化关系如下(部分产物已略去):
,Y元素最高正价与它的负价代数和为6。M与其它物质的转化关系如下(部分产物已略去): ;
;