19. (7分)设反应①Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数为K1。
(7分)设反应①Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数为K1。
 反应②Fe(s)+H2O (g) FeO(s)+H2 (g)的平衡常数为K2,在不同温度下K1、K2的值如
反应②Fe(s)+H2O (g) FeO(s)+H2 (g)的平衡常数为K2,在不同温度下K1、K2的值如
下:
|
T(K) |
K1 |
K2 |
|
973 |
1.47 |
2.36 |
|
1173 |
2.15 |
1.67 |
(1)平衡常数K1的表达式为 。
 (2)现有反应③CO2(g)+H2(g)
CO(g)+H2O(g),这是一个
(填“吸”
(2)现有反应③CO2(g)+H2(g)
CO(g)+H2O(g),这是一个
(填“吸”
或“放”)热反应,要使反应③在一定条件下建立的平衡向右移动,可采取的措施
的有 。
A.缩小反应容器容积 B.扩大反应容器容积
C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的量

 (3)若反应Fe(s)+CO2(g) CO(g)+H2O(g)在温度T1下进行;Fe(s)+H2O(g) FeO(s)
(3)若反应Fe(s)+CO2(g) CO(g)+H2O(g)在温度T1下进行;Fe(s)+H2O(g) FeO(s)
+H2 (g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则
两者的反应速率 (填序号)
A.前者大 B.后者大 C.一样大 D.无法判断
17. (12分)现有下列短周期元素性质的数据:
(12分)现有下列短周期元素性质的数据:
|
|
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径(10-10m) |
0.73 |
1.02 |
1.34 |
1.06 |
0.99 |
1.54 |
0.75 |
1.18 |
|
最高或最低化合价 |
|
+6 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
-2 |
-2 |
|
-3 |
-1 |
|
-3 |
|
试回答下列问题:
(1)元素③在周期表中的位置是 ;元素④与元素⑦相比较,气态氰化物较稳定
的是 (填化学式);
(2)元素①与元素⑥按照原子个数比为1:1形成的化合物中化学键的类型为
。
(3)Y和Z均由元素①组成,反应Y+2I-+2H+===I2+Z+H2O常作为Y的鉴定反应。
Ⅰ.Y与Z的关系是(选填字母) :
a.同位素 b.同素异形体 c.同系物 d.同分异构体
Ⅱ.将Y和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区分二者的实验方法
;
(4)元素⑤的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶
液,并放出QkJ的热量。写出该反应的热化学方程式 ;
(5)元素①单质和元素⑧单质在海水中可以形成原电池,写出正极反应式:
。
 (1)钢铁在冷的浓硝酸中浸泡能防腐的原因是:
(1)钢铁在冷的浓硝酸中浸泡能防腐的原因是: 某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应: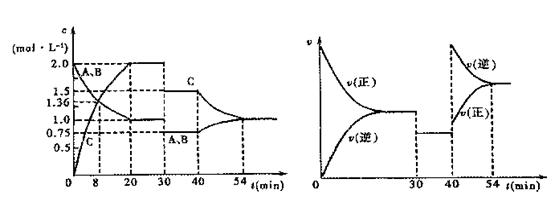 A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、
A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、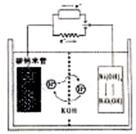 一种碳纳米管(氢气)二次电池原理如右图,该电池的电解质为6mol·L-1KOH溶液,
一种碳纳米管(氢气)二次电池原理如右图,该电池的电解质为6mol·L-1KOH溶液,