23.(10分)硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了Na2SO4中的一个O原子而
形成。某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性
质。
[提出问题]Na2S2O3是否与Na2SO4相似而具备下列性质呢?
猜想①:溶液呈中性,且不与酸反应;
猜想②:无还原性,不能被氧化剂氧化
[实验探究]基本上述猜想①②,设计实验方案。
|
|
实验操作过程 |
实验现象或预 期实验现象 |
现象解释(用离子方程式表示) |
|
猜想① |
|
溶液pH=8 |
 |
|
向pH=2的硫酸中滴加Na2S2O3溶液 |
|
S2O32-+2H+===S↓+SO2↑+H2O |
|
|
猜想② |
向新制氯气(pH<2)中滴加少量Na2S2O3溶液 |
氯气颜色变浅 |
|
[实验结论]Na2S2O3能与酸反应,具有还原性,与Na2SO4的化学性质不相似
[问题讨论]
(1)甲同学取探究“猜想②”反应后的溶液少量,滴加硝酸银溶液,观察到有白色沉淀,
并据此认为氯气可将Na2S2O3氧化。你认为该方案是否合理并说明理由 。
(2)若方案不合理,请你设计一个实验方案,证明Na2S2O3被氯气氧化 。
22.(10分)(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的元酸)和NaOH溶
液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
|
实验编号 |
HA的物质的量浓度 (mol·L-1) |
NaOH的物质的量浓度 (mol·L-1) |
混合后溶液的pH |
|
甲 |
0.1 |
0.1 |
pH=a |
|
乙 |
0.12 |
0.1 |
pH=7 |
|
丙 |
0.2 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸? 。
(2)乙组混合溶液中粒子浓度c(A-)和c(Na+)的大小关系 。
A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中粒子浓度由大到小的顺序是 。
(4)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)= mol·L-1
 (Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
H2B====H++HB- HB- H++ B2-
回答下列问题:
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2-)+ c(HB-)=0.1mol/L B.c(B2-)+ c(HB-)+ c(H2B)=0.1mol/L
C.c(OH-)= c(H+)+ c(HB-) D.c(Na+)+c(OH)=c(H+)+c(HB-)
20.(7分)
①CaCO3(s)=CaO(s)+CO2(g) △H=177.7kJ
②C+H2O=CO+H2 △H=-131.3kJ.mol-1
③2S(g)+O2 (g)=2SO2 (g) △H1=a kJ.mol-1
④2S(s)+O2 (g)=2SO2 (g) △H2=b kJ.mol-1
⑤CO(g)+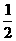 O2 (g)=CO2 (g) △H=-283kJ.mol-1
O2 (g)=CO2 (g) △H=-283kJ.mol-1
⑥C(s)+O2 (g)=CO2 (g) △H=-393.5kJ.mol-1
 ⑦N2 (g)+3H2
(g) 2NH3(g) △H=-92.4kJ.mol-1
⑦N2 (g)+3H2
(g) 2NH3(g) △H=-92.4kJ.mol-1
(1)上述热化学方程式中明显不正确的有 (填序号,下同)
(2)上述反应中表示燃烧热的热化学方程式的有 。
(3)比较△H1 △H2(选填“=”、“>”、“<”=
(4)根据上述信息,写出C燃烧转化为CO气体的热化学方程式 。
(5)对于反应⑦,在恒温恒压的条件下,三个容器中分别充入的气体和反应的焓变
(△H)如下表所示
|
容器 |
N2(mol) |
H2(mol) |
Ne(mol) |
△H |
|
甲 |
1 |
3 |
0 |
△H1 |
|
乙 |
2 |
6 |
0 |
△H2 |
|
丙 |
2 |
6 |
1 |
△H3 |
根据以上数据,下列叙述正确的是 。
A.△H1=-92.4kJ.mol-1 B.△H2=△H3<△H1
C.△H1>△H3>△H2 D.△H2=2△H1<△H3
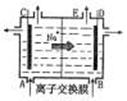 A.从E口逸出的气体是H2
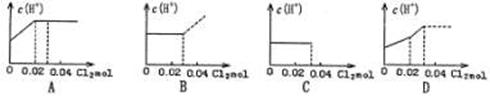
A.从E口逸出的气体是H2 在一定条件下,对于反应mA(g)+nB(g) cC(g)+dD(g),C物质的浓度(c%)与温度、
在一定条件下,对于反应mA(g)+nB(g) cC(g)+dD(g),C物质的浓度(c%)与温度、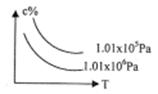 压强的关系如图所示,下列判断正确的是 ( )
压强的关系如图所示,下列判断正确的是 ( )