23.下表列出了元素周期表中的部分元素(用元素符号或名称表示):
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B |
C |
N |
O |
F |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Si |
P |
S |
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
锗 |
As |
Se |
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
锑 |
Te |
I |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
铋 |
At |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
117 |
|
(1)表中用元素符号所列出的元素除H外,其余非金属元素原子 (填序号)。
a.最外层电子数都大于4
b.主族序数等于周期数
c.最外层电子数都大于电子层数
(2)以下关于元素的性质或用途的叙述正确的是 (填序号)。
a.P、S、Cl等元素的化合物常用来制取农药
b.硅(Si)、锗(Ge)可用于制半导体材料
c.F是最活泼非金属元素,其最高价氧化物的水化物的酸性最强
(3)以下方法可以比较S、Cl非金属性强弱的是 (填序号)。
a.分别测定Na2S溶液和NaCl溶液的pH
b.将Fe分别与S、Cl2反应,分析产物中Fe的化合价
c.将H2S通入氯水中,观察到有淡黄色固体析出:H2S + Cl2 → 2HCl + S↓
(4)美俄科学家2006年10月5日宣布他们已制得了118号元素。试分析,若制得117号元素(位置见表),按元素周期表中金属与非金属的分区,它应是一种 (选填“金属”、“非金属”)元素,写出117号元素最外层电子排布式 。
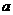 gM和
gM和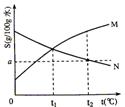 A.t1℃时,M、N的溶解度相等,得到M、N的饱和溶液
A.t1℃时,M、N的溶解度相等,得到M、N的饱和溶液
 化学试卷
化学试卷 第II卷(共84分)
第II卷(共84分)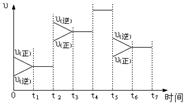 下图表示反应
下图表示反应 在某一时间段中反应速率与反应过程的关系。由图判断,SO3的百分含量最高的一段时间是
在某一时间段中反应速率与反应过程的关系。由图判断,SO3的百分含量最高的一段时间是