23.(13分)红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。

①步骤I中反应的化学方程式为:
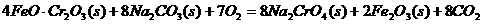 该反应的化学平衡常数的表达式为
,在常温下该反应速度极慢,下列措施中能使反应速率增大的是
。
该反应的化学平衡常数的表达式为
,在常温下该反应速度极慢,下列措施中能使反应速率增大的是
。
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是 、 。
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是 。
④步骤Ⅳ中发生反应的离子方程式为: 。
(2)将红矾钠与KCl固体按1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体。请填写表中空格,完成上述过程。(已知:在室温下重铬酸钾溶解度很小,而在升高温度时,其溶解度大大增加)。
|
序号 |
实验步骤 |
简述实验操作(不必叙述如何组装实验装置) |
|
① |
溶解 |
将混合物放入烧杯中,加入热的蒸馏水,充分搅拌直到固体不再溶解。 |
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
|
⑤ |
过滤、干燥 |
得到K2Cr2O7晶体 |
22.(8分) 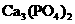 、
、 均为难溶于水的白色固体.某同学向
均为难溶于水的白色固体.某同学向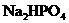 溶液中滴加
溶液中滴加 溶液至恰好反应,生成白色沉淀。试设计一个简单的实验方案,来证明所生成的白色沉淀是
溶液至恰好反应,生成白色沉淀。试设计一个简单的实验方案,来证明所生成的白色沉淀是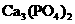 还是
还是 。(已知:
。(已知: 水解程度大于电离程度)
水解程度大于电离程度)
|
实验原理______________________________________________________ 实验用品及试剂:烧杯、玻璃棒、表面皿、试管、滴管;石蕊试液、酚酞、pH试纸 |
|
实验步骤、现象及结论:(可以不填满) A.___________________________________________________________ B.___________________________________________________________ C.___________________________________________________________ D.___________________________________________________________ E.___________________________________________________________ |
21.(9分)为了探究硫化钠晶体(Na2S•nH2O)在空气中的变化,某兴趣小组的实验步骤及现象记录如下:①将少量硫化钠晶体置于表面皿上,暴露在空气中。②三天后将样品放入盛水的烧杯中,搅拌后得无色澄清溶液。③取少量该溶液加入过量盐酸中,有气体放出,且溶液保持澄清。
⑴请你根据上述记录猜想所放出气体的成分可能是(至少写出三种)
________________________________________________________________________。
⑵若所放出气体为两种气体的混合气体,请使用品红溶液、浓溴水、澄清石灰水三种试剂设计一个组合实验分析该混合气体的组成,简要写出实验方案、现象和结论。
|
实验方案 |
可能的现象和相应的结论 |
|
|
|
|
|
⑶如果要检验硫化钠晶体是否被氧化生成了硫酸钠,请简要说明检验的方法、现象和结论(可在兴趣小组实验的基础上设计实验):____________________________________
________________________________________________________________________。
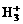 离子,其构型为等边三角型,属于二电子三中心离子。同时
离子,其构型为等边三角型,属于二电子三中心离子。同时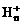 。有关判断正确的是
。有关判断正确的是 A.
A. 、
、 、
、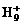
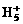 、
、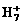 、
、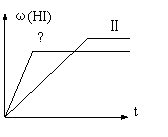 一定温度下发生反应:
一定温度下发生反应: 2HI(g) △H<0, 并达到平衡,HI的体
2HI(g) △H<0, 并达到平衡,HI的体 B.不论哪种硫分子,完全燃烧时肯定都生成SO2
B.不论哪种硫分子,完全燃烧时肯定都生成SO2