22.(7分)标准状况下进行下列实验:甲、乙、丙各取30.0mL同浓度的盐酸,加入同一种镁铝合金,所取合金质量和产生气体的体积如表所列,求:
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量(mg) |
510 |
765 |
918 |
|
气体体积(mL) |
550 |
672 |
672 |
(1)盐酸的物质的量浓度= ;(2分)
(2)合金中Mg的质量分数= ;(2分)
(3)丙实验后,还需向容器中加入1.00mol/L的NaOH溶液 mL才能使剩余合金中的铝粉恰好完全溶解。(3分,此问要有计算过程,否则无分)
19.(14分)如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
(1)电源A上的a为 极
(2)滤纸B上发生的总化学方程式为:
|
(4)若A中的总反应为:CH4+2O2+2KOH K2CO3+3H2O,
则a电极反应式为: ;
b电极反应式为: 。
14.在25℃时,某溶液由水电离出的氢离子的浓度为1×10-12mol/L,下列说法错误的是
( )
|
B.该溶液的pH不可能2
C.向该溶液中加入铝片后,可能生成氢气
D.若该溶液中的溶质只有一种,则它可能是酸,或者是碱,或者是盐

 N2+3H2 2NH3,达到平衡后,NH3的体积分数为a%。
N2+3H2 2NH3,达到平衡后,NH3的体积分数为a%。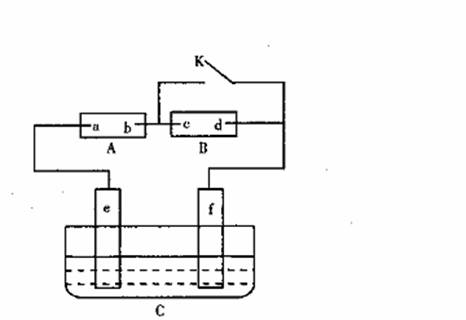 (2)若保持温度容积不变,加入a mol N2、b mol H2、cmol NH2,达到平衡时要使NH3的体积分数仍为a%,则a、b、c应同时满足:
。若改为温度和压强不变,则应满足
。
(2)若保持温度容积不变,加入a mol N2、b mol H2、cmol NH2,达到平衡时要使NH3的体积分数仍为a%,则a、b、c应同时满足:
。若改为温度和压强不变,则应满足
。 在恒温下的密闭容器中,有可逆反应2NO(g)+O2(g) 2NO2(g);△H<0不能说明已达到平衡状态的是 ( )
在恒温下的密闭容器中,有可逆反应2NO(g)+O2(g) 2NO2(g);△H<0不能说明已达到平衡状态的是 ( )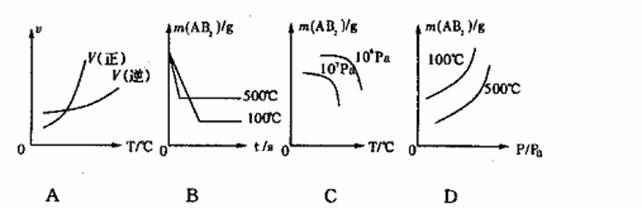
 16.在可逆反应A2(g)+2B2(g) 2AB2(g);△H<0趋向平衡时,下图中符合勒夏特列原理的是 ( )
16.在可逆反应A2(g)+2B2(g) 2AB2(g);△H<0趋向平衡时,下图中符合勒夏特列原理的是 ( )