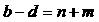20.(13分)碱式氯化铝[Al2(OH)nCl6-n]m (1≤n≤6,m≤10) (商业代号BAC),是一种比Al2(SO4)3效果更好的净水药剂。以下是用煤矸石(主要含Al2O3,SiO2及少量铁的氧化物)为原料生产碱式氯化铝过程中遇到的情况:
⑴在反应器中加入16%的硫酸和16%的盐酸,在不断搅拌过程中再加入经过焙烧后的煤矸石粉,反应器上部有一条长管子作为反应时气体的排放管。加热至沸腾(102℃)并保持一段时间,期间不断用精密pH试纸在排气管口上方检查排出气体的pH,记录如下:
|
时间 |
起始 |
14min后 |
30min后 |
75min后 |
|
pH |
<2.0 |
=2.5 |
<3.5 |
=3.5 |
试解释排气管中放出气体的pH变化的原因。如果把排气管加长一倍,排气的pH有无变化? 为什么?
⑵观察反应器内溶液的颜色(取上面清液观察),在沸腾1h内,溶液逐渐呈黄绿色,以后逐渐转变为淡棕黄色,1.5h后呈棕红色。解释导致颜色变化的原因。
⑶上述反应结束后,冷却,过滤弃渣,然后再加热至100℃,并在不断搅拌的条件下,向溶液慢慢地添加Ca(OH)2至适量,生成大量沉淀。过滤上述溶液,弃渣,得到澄清的BAC稀溶液。将此稀溶液加热蒸发浓缩,又产生白色细晶状沉淀,经化验分析,知此沉淀不是BAC固体,也不是AlCl3晶体或Al(OH)3。问:这是什么物质? 为什么此时会有沉淀析出?
15. 有五列同族元素的物质,在101.3KP时测定它们的沸点(℃)如下表所示:
|
① |
He -268.8 |
(a) -249.5 |
Ar -185.8 |
Kr -151.7 |
|
② |
F2 -187.0 |
Cl2 -33.6 |
(b) 58.7 |
I2 -184.0 |
|
③ |
(c) 19.4 |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
|
④ |
H2O 100.0 |
H2S -60.2 |
(d) -42.0 |
H2Te -1.8 |
|
⑤ |
CH4 -161.0 |
SiH4 -112.0 |
GeH4 -90.0 |
(e) -52.0 |
对应表中内容,下列各项中正确的是
A.a、b、c的化学式分别为Ne、Br2、HF
B.第②列物质均有氧化性;第③列物质对应水溶液均是强酸。
C.系列④中各化合物的稳定性顺序为: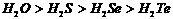
D.上表中物质HF和H2O以外,由于氢键的影响,其分子特别稳定。
第Ⅱ卷(非选择题 共90分)
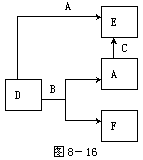
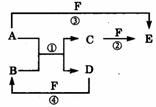 A、B、C、D、E、F六种物质的相互转化关系如附图所示(反应条件未标出)。
A、B、C、D、E、F六种物质的相互转化关系如附图所示(反应条件未标出)。 ⑵根据溶解度曲线回答下列问题:
⑵根据溶解度曲线回答下列问题: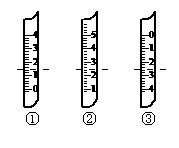 试填空:
试填空: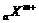 、
、 、
、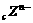 、
、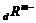 四种元素的离子的电子层结构相同(a、b、c、d为元素的原子序数),则
四种元素的离子的电子层结构相同(a、b、c、d为元素的原子序数),则