26、 (12’)400mL0.500mol L-1的NaOH溶液中通入一定量的SO2气体,然后在低温下蒸发溶液,得到白色固体A。
(12’)400mL0.500mol L-1的NaOH溶液中通入一定量的SO2气体,然后在低温下蒸发溶液,得到白色固体A。
(1)推测此白色固体A所有可能的组成,将其化学式填入下表。
|
编 号 |
① |
② |
③ |
④ |
|
组成A的物质 的化学式 |
|
|
|
|
(2)若A的质量为16.7g,通过计算确定A的物质组成及其质量。
秋学期第一次质量抽测
高三化学答案卷 命题人:马罗平
25、(6’)为测定wgKNO3样品的纯度(杂质不溶于水),放入一定量的水中充分搅拌,测得如下数据:
|
温度(℃) |
10 |
40 |
75 |
|
剩余固体质量(g) |
18.9 |
10.3 |
1 |
|
溶解度(g/100gH2O) |
20.9 |
63.9 |
150 |
求:(1)一定量的水的质量;(2)样品的质量(w);(3)样品的纯度。
(计算结果保留3位有效数字)
23、(14’)形成酸雨的原理之一可简示如下:
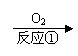 |
|
||||
|
|||||

 含硫燃料
A
B
硫酸。回答下列问题:
含硫燃料
A
B
硫酸。回答下列问题:
(1)A物质的化学式________,B物质的化学式___________。
(2)三个反应中不属于氧化还原反应的是_____________(填序号)
(3)SO2中硫元素显+4价,它可能降低到0价,利用这一性质可在工厂烟道气中通入合适的____________(填“氧化剂”或“还原剂”)除去SO2,达到减小污染的目的。
(4)从环境保护的角度认为:雨水的pH<5.6时,就判断为酸雨,已知pH= -lgc(H+),经测定某次雨水只含硫酸,且浓度为5×10-5mol/L,这次降雨__________(填“是”或“不是”)酸雨。
(5)火力发电厂燃烧的煤中含有大量的硫,其排出的废气中往往含有SO2、O2、N2、CO2等。为了除去有害的SO2气体,在英国已进行的一个研究结果表明:高烟囱可以有效降低地表面SO2浓度。在20世纪60年代到70年代的10年间,由发电厂排放的SO2增加了35%。但由于建造高烟囱的结果,地面浓度降低了30%之多。
(Ⅰ)你认为减少酸雨产生的途径可采取的措施是____________
(A)少用煤作燃料 (B)把工厂烟囱造高
(C)燃料脱硫 (D)把工厂迁移到农村 (E)开发新能源
(Ⅱ)请从全球环境保护角度,分析这种建造高烟囱的方法是否可取________,理由是___________________________________________________________________。

 将浓缩后含CN-的废水与过量NaClO溶液的混合液(其中CN-浓度为0.05mol L-1)200mL倒入甲中,塞上橡皮塞,一段时间后,打开活塞。使溶液全部放入乙中,关闭活塞。
将浓缩后含CN-的废水与过量NaClO溶液的混合液(其中CN-浓度为0.05mol L-1)200mL倒入甲中,塞上橡皮塞,一段时间后,打开活塞。使溶液全部放入乙中,关闭活塞。 (6’)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:_______________。若1g水蒸气转化成液态水放热2.444
kJ,则反应H2(g)+ O2(g) = H2O(1)的△H=______________ kJ mol-1。氢气的燃烧热为______________。
(6’)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:_______________。若1g水蒸气转化成液态水放热2.444
kJ,则反应H2(g)+ O2(g) = H2O(1)的△H=______________ kJ mol-1。氢气的燃烧热为______________。 (12分)某同学每次量取50mL0.55mol L-1NaOH溶液和50mL0.50mol L-1HCl溶液混合反应,做“中和热的测定”实验,回答下列问题:
(12分)某同学每次量取50mL0.55mol L-1NaOH溶液和50mL0.50mol L-1HCl溶液混合反应,做“中和热的测定”实验,回答下列问题: