4.下列哪一组元素的原子间反应容易形成离子键
( )
|
原子 |
a |
b |
c |
d |
e |
f |
g |
|
M层电子数 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
A.a和c B.a和f
C.d和g D.b和g
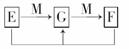
解析:由原子a-g的M层电子数可知,M层即为原子的最外层,元素a-g均为第三周期元素.a、b均为活泼的金属元素,f、g均为活泼的非金属元素,所以a与f、b与g形成的化学键为离子键.
答案:BD