摘要:20.(2009·安徽合肥高三质检)等物质的量混合的NaHCO3和KHCO3的混合物4.60 g.与1.00 mol/L的盐酸反应. (1)试分析.欲求标准状况下生成的CO2气体的体积.还需要什么数据 (用a表示.并注明单位). (2)利用所确定的数据.求标准状况下CO2气体的体积: 所需数据取值范围 生成CO2气体的体积 盐酸不足量时 盐酸足量时 (3)若NaHCO3和KHCO3的物质的量不相等.则4.60 g的混合物与足量盐酸完全反应时.标准状况下生成的CO2气体的体积大于 L.小于 L. 解析:(1)欲求标准状况下生成CO2气体的体积.还需知道盐酸的体积.(2)由题干数据知n(NaHCO3)=n(KHCO3)=0.0250 mol.则n(HCO)=0.0500 mol.当盐酸量不足时.n(HCl)<0.0500 mol.即a<0.0500 L,若盐酸足量.则a≥0.0500 L.产生CO2气体体积分别是27.4a L.1.12 L. (3)当NaHCO3与KHCO3物质的量不相等时.若全部是NaHCO3产生CO2的量最多.当全部是KHCO3时.产生CO2的量最少.故生成CO2的体积 L<V< L.即1.03 L<V<1.23 L. 答案:(1)盐酸的体积a L (2) 所需数据取值范围 生成CO2气体的体积 盐酸不足量时 a<0.0500 22.4a L 盐酸足量时 a≥0.0500 1.12 L (3)1.03 1.23
网址:http://m.1010jiajiao.com/timu3_id_83448[举报]
在常温常压下,a,b,c,d 四支相同的试管中,分别装入以等物质的量混合的两种气体.a试管内是NO2和O2,b试管内是Cl2和SO2,c试管内是NO和O2,d试管内是O2和H2.将四支试管迅速同时倒立于水中,最终水面上升高度h的比较,正确的是( )
查看习题详情和答案>>
常温常压下,在四支试管中分别装入等物质的量混合的两种气体并倒立于水槽中a、NO2、O2;b、Cl2、SO2;c、NO、O2;d、NH3、N2,最后水面上升的高度正确的是( )
| A、b<c<a<d | B、d<a<c<b | C、d<b<a<c | D、d<c<a<b |
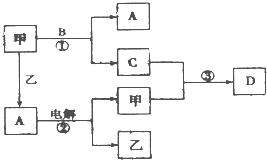 A、B、C、D是由短周期元素组成的四种常见的化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图所示的转化关系:
A、B、C、D是由短周期元素组成的四种常见的化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图所示的转化关系:(1)上述转化过程中包含的反应类型有
BC
BC
(填序号)A.置换反应B.化合反应C.分解反应D.复分解反应
(2)在反应②中,阳极的电极反应方程式为
4OH--4e-=2H2O+O2↑
4OH--4e-=2H2O+O2↑
;(3)乙在甲中燃烧,当有1mol电子转移,生成液态A时,放出142.9kJ的热量,则该反应的热化学方程式为
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
;(4)反应③在一定条件下为可逆反应,若将3mol甲和4molC混合充入2L的密闭容器中,2min后达到平衡.平衡后混合气体的总物质的量为6mol,则甲的反应速率为
0.25mol/(L.min)
0.25mol/(L.min)
,该平衡混合气体溶于水,恰好完全被水吸收,该反应的总化学方程式为NO+NO2+O2+H2O═HNO3
NO+NO2+O2+H2O═HNO3
.(5)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程简单表示如下:
①将气体B通入等物质的量混合的FeSO4、Fe2(SO4)3溶液中,生成两种碱,写出该过程的总离子方程式:
Fe2++2Fe3++8NH3.H2O═Fe(OH)2↓+2Fe(OH)3↓+NH4+
Fe2++2Fe3++8NH3.H2O═Fe(OH)2↓+2Fe(OH)3↓+NH4+
;②上述反应生成的两种碱继续作用,得到Fe3O4,该反应的化学方程式为
Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O
Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O
.(2013?辽宁一模)已知物质A、B、C、D、E是由短周期元素构戚的单质或化合物,它们可发生如图所示的转化关系
(1)若条件①为点燃,目前60%的B都是从海水中提取的,气体D可以使湿润的红色石蕊试纸变蓝,写出C与H2O反应的化学方程式
上世纪60年代就有人将气体D作为燃料电池的燃料源进行了试验,制成D-空气燃料电池系统,总反应式为:D+O2→A+H2O(未配平),写出此碱性燃料电池的负极反应式:
(2)若条件①为加热,E是一种两性氢氧化物,气体D是一种有臭鸡蛋气味的气体,其水溶液是还原性酸,写出D与NaOH等物质的量混合的离子方程式:
(3)若条件①为常温,B和D为同-种无色气体,常温下E的浓溶液可以使Fe钝化,写出少量Fe粉与E的浓溶液在加热条件下反应的化学方程式:
已知常温下A与B反应生成1molC的焓变为-57.07kJ/mol,1molC与H2O反应生成气体D和E溶液的焓变为-46kJ/mol,写出A、B与水反应生成E溶液的热化学方程式:
查看习题详情和答案>>

(1)若条件①为点燃,目前60%的B都是从海水中提取的,气体D可以使湿润的红色石蕊试纸变蓝,写出C与H2O反应的化学方程式
Mg3N2+6H2O=3Mg(OH)2+2NH3↑
Mg3N2+6H2O=3Mg(OH)2+2NH3↑
.上世纪60年代就有人将气体D作为燃料电池的燃料源进行了试验,制成D-空气燃料电池系统,总反应式为:D+O2→A+H2O(未配平),写出此碱性燃料电池的负极反应式:
2NH3+6OH--6e-=N2↑+6H2O
2NH3+6OH--6e-=N2↑+6H2O
.(2)若条件①为加热,E是一种两性氢氧化物,气体D是一种有臭鸡蛋气味的气体,其水溶液是还原性酸,写出D与NaOH等物质的量混合的离子方程式:
H2S+OH-=HS-+H2O
H2S+OH-=HS-+H2O
.(3)若条件①为常温,B和D为同-种无色气体,常温下E的浓溶液可以使Fe钝化,写出少量Fe粉与E的浓溶液在加热条件下反应的化学方程式:
Fe+6HNO3(浓)
Fe(NO3)3+3NO2↑+3H2O
| ||
Fe+6HNO3(浓)
Fe(NO3)3+3NO2↑+3H2O
;
| ||
已知常温下A与B反应生成1molC的焓变为-57.07kJ/mol,1molC与H2O反应生成气体D和E溶液的焓变为-46kJ/mol,写出A、B与水反应生成E溶液的热化学方程式:
4NO(g)+3O2(g)+2H2O(l)=4HNO3(aq)△H=-618.42kJ/mol
4NO(g)+3O2(g)+2H2O(l)=4HNO3(aq)△H=-618.42kJ/mol
.