解析:同周期中从左到右,元素的第一电离能(除ⅢA族、ⅥA族反常外)逐渐增大,同周期中金属元素最小,稀有气体最大,故第三周期中第一电离能最小的为Na,最大的为Ar。
答案:(1)Na Ar (2)Cs (3)F (4)N、P、As
5.现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
T |
M层上有2对成对电子 |
|
X |
最外层电子数是次外层电子数的2倍 |
|
Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
|
Z |
元素最高正价是+7价 |
(1)元素T的原子最外层共有________种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是________。
(2)元素Y与氢元素形成一种离子YH,写出该微粒的电子式____________________(用元素符号表示)。
(3)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种的是________,理由是________________________________________________________________________。
解析:(1)因T的M层上有2对成对电子,其电子排布式为1s22s22p63s23p4,因此它是硫元素,其最外层有6种不同运动状态的电子,从X的原子结构:“最外层电子数是次外层的电子数的2倍”,且其一种同位素可测定文物年代推知X为碳元素,其同位素符号是C。
(2)因元素Y单质为双原子分子,其氢化物水溶液显碱性推出Y为氮元素,Y与H形成的YH即NH,其电子式为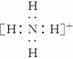 。
。
(3)Z属短周期元素,其最高正价为+7价,则可推知Z为氯元素,它的非金属性比硫强,可以通过b来证实。
(4)从T、X、Y、Z四种元素的最高价氧化物对应水化物来看,分子为H2SO4、H2CO3、HNO3和HClO4,显然H2CO3的性质与其他三种不同,因只有它是非氧化性的酸且是弱酸。
答案: (1)6 C (2)
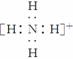 (3)Cl b (4)H2CO3 弱酸性或非氧化性酸
(3)Cl b (4)H2CO3 弱酸性或非氧化性酸
11. (2008·广东化学,27)镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有________________。
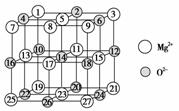
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如下图所示,请改正图中错误:___________________________________________________________。
(3)用镁粉、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:________________________________________________________________________。
(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
|
氟化物 |
NaF |
MgF2 |
SiF4 |
|
熔点/K |
1 266 |
1 534 |
183 |
解释表中氟化物熔点差异的原因:________________________________________________________________________。
(5)人工模拟酶是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当其结合
 或Cu(Ⅰ)(Ⅰ表示化合价为+1)时,分别形成a和b:
或Cu(Ⅰ)(Ⅰ表示化合价为+1)时,分别形成a和b:
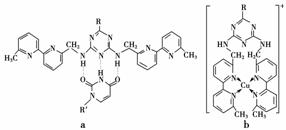
①a中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有________键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异________________________________________________________________________
________________________________________________________________________。
解析:(1)Na+、K+、Ca2+氧化性不如Mg2+,不参与放电,只能增强导电性。
(2)因O2-、Mg2+均为10电子微粒,但质子数O2-少于Mg2+,O2-微粒半径较大。
(4)应掌握分子晶体、离子晶体、原子晶体、金属晶体的熔沸点变化规律及影响因素。
答案:(1)增强熔融盐的导电性 (2)空心球应为O2-,实心球应为Mg2+;8号空心球改为实心球
(3)电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量 (4)离子晶体微粒间的作用力随阳离子半径的减小、电荷的增大而增大,故MgF2的熔点高于NaF;SiF4是分子晶体,晶体微粒间的作用力为范德华力,因而熔点较低 (5)①σ ②a中存在分子间氢键和范德华力,b中存在配位键
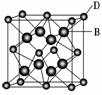

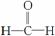 空间构型为平面三角形。甲醛中C-H键均为σ键,碳氧双键中有一个σ键,故有3个σ键。弄清晶胞中位于顶点与体心的空心圆为O,则O原子数=8×+1=2,4个位于体心的黑点为Cu,Cu原子数为4,满足n(Cu)∶n(O)=2∶1。
空间构型为平面三角形。甲醛中C-H键均为σ键,碳氧双键中有一个σ键,故有3个σ键。弄清晶胞中位于顶点与体心的空心圆为O,则O原子数=8×+1=2,4个位于体心的黑点为Cu,Cu原子数为4,满足n(Cu)∶n(O)=2∶1。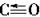 ) (3)①甲醇分子之间形成氢键 sp2杂化 ②平面三角形 3NA ③4
) (3)①甲醇分子之间形成氢键 sp2杂化 ②平面三角形 3NA ③4