摘要: Q.R.X.Y.Z五种元素的原子序数依次递增.已知: ①Z的原子序数为29.其余的均为短周期主族元素, ②Y原子价电子排布为msnmpn, ③R原子核外L层电子数为奇数, ④Q.X原子p轨道的电子数分别为2和4. 请回答下列问题: (1)Z2+的核外电子排布式是 . (2)在[Z(NH3)4]2+离子中.Z2+的空轨道接受NH3分子提供的 形成配位键. (3)Q与Y形成的最简单气态氢化物分别为甲.乙.下列判断正确的是 . a.稳定性:甲>乙.沸点:甲>乙 b.稳定性:甲>乙.沸点:甲<乙 c.稳定性:甲<乙.沸点:甲<乙 d.稳定性:甲<乙.沸点:甲>乙 (4)Q.R.Y三种元素的第一电离能数值由小至大的顺序为 . (5)Q的一种氢化物相对分子质量为26.其分子中σ键与π键的键数之比为 . (6)五种元素中.电负性最大与最小的两种非金属元素形成的晶体属于 . 解析:Z原子序数为29.则Z是Cu.Y原子价电子排布为msnmpn.则n为2.Y是ⅣA族短周期元素.用Q.R.X.Y原子序数依次递增.由③知R.Q在第二周期.由④知Q为C.X在ⅥA族.原子序数X<Y.则X为O.Y为Si.R为N.(1)Cu2+核外电子排布式是1s22s22p63s23p63d9.(2)在[Cu(NH3)4]2+中Cu2+的空轨道接受NH3分子提供的孤对电子形成配位键.(3)稳定性是CH4>SiH4.因为C非金属性比Si强,沸点是SiH4>CH4.是因为组成和结构相似的分子.其相对分子质量越大.分子间作用力越强.其沸点越高.故选b.(4)C.N.Si元素中N非金属性最强.其第一电离能数值最大.(5)C的相对分子质量为26的氢化物是C2H2.乙炔分子中碳原子与碳原子间形成了一个σ键和两个π键.碳原子与氢原子间形成两个σ键.则乙炔分子中σ键与π键键数之比是3∶2. 答案:(1)1s22s22p63s23p63d9 Si<C<N (5)3∶2 (6)原子晶体
网址:http://m.1010jiajiao.com/timu3_id_80073[举报]
I.下列说法正确的是 (填字母编号,每小题只有一个正确答案,下同)
A.离子晶体中一定存在离子键,分子晶体中一定存在共价键
B.主族元素形成的单质,从上到下熔沸点逐渐升高
C.N2分子中的共价键是由两个σ键和一个π键组成的
D.以极性键结合的分子不一定是极性分子
II.下列叙述正确的是 .
A.用VSERP理论预测PCl3的立体构型为平面三角形
B.SO2和CO2都是含有极性键的非极性分子
C.在NH+4和[Cu(NH3)4]2+中都存在配位键
D.铝元素的原子核外共有5种不同运动状态的电子
III.Q、R、X、Y、Z五种元素的原子序数逐渐增大.已知Z的原子序数为29,其余均为短周期主族元素.Y原子的价电子排布为msnmpn.R原子核外L层的电子数为奇数,Q、X原子p轨道的电子数分别为2和4.请回答下列问题: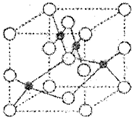
(1)Z2+的核外电子排布式是 .如图是Z和X形成晶体的晶胞结构示意图(O代表X),可确定该晶胞中阴离子的个数为 .
(2)Q与Y形成的最简单气态氢化物分别为A、B,试比较它们的热稳定性并说明理由:
.
(3)Q和X形成的一种化合物甲的相对分子质量为44,则甲的空间构型是 ,中心原子采取的杂化轨道类型是 ,该分子中含有 个π键.
(4)R有多种氧化物,其中乙的相对分子质量最小.在一定条件下,2L的乙气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是 .
(5)这五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 晶体;Q、R、X三种元素的第一电离能数值由小到大的顺序为 (用元素符号作答)
查看习题详情和答案>>
A.离子晶体中一定存在离子键,分子晶体中一定存在共价键
B.主族元素形成的单质,从上到下熔沸点逐渐升高
C.N2分子中的共价键是由两个σ键和一个π键组成的
D.以极性键结合的分子不一定是极性分子
II.下列叙述正确的是
A.用VSERP理论预测PCl3的立体构型为平面三角形
B.SO2和CO2都是含有极性键的非极性分子
C.在NH+4和[Cu(NH3)4]2+中都存在配位键
D.铝元素的原子核外共有5种不同运动状态的电子
III.Q、R、X、Y、Z五种元素的原子序数逐渐增大.已知Z的原子序数为29,其余均为短周期主族元素.Y原子的价电子排布为msnmpn.R原子核外L层的电子数为奇数,Q、X原子p轨道的电子数分别为2和4.请回答下列问题:

(1)Z2+的核外电子排布式是
(2)Q与Y形成的最简单气态氢化物分别为A、B,试比较它们的热稳定性并说明理由:
(3)Q和X形成的一种化合物甲的相对分子质量为44,则甲的空间构型是
(4)R有多种氧化物,其中乙的相对分子质量最小.在一定条件下,2L的乙气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是
(5)这五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于
Q、R、X、Y、Z五种元素的原子序数依次递增.已知:①Z的原子序数为29,其余的均为短周期主族元素;②Y原子价电子(外围电子)排布msnmpn;③R原子核外L层电子数为奇数;④Q、X原子p轨道的电子数分别为2和4.请回答下列问题:
(1)Z2+的核外电子排布式是 .
(2)在[Z(NH3)4]2+离子中,Z2+的空轨道接受NH3分子提供的 形成配位键.
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 .
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为 (用元素符号作答)
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 ,其中心原子的杂化类型是 .
(6)若电子由3d能级跃迁至4p能级时,可通过光谱仪直接摄取 .
A.电子的运动轨迹图象 B.原子的吸收光谱
C.电子体积大小的图象 D.原子的发射光谱
(7)某元素原子的价电子构型为3d54S1,该元素属于 区元素,元素符号是 .
查看习题详情和答案>>
(1)Z2+的核外电子排布式是
(2)在[Z(NH3)4]2+离子中,Z2+的空轨道接受NH3分子提供的
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为
(6)若电子由3d能级跃迁至4p能级时,可通过光谱仪直接摄取
A.电子的运动轨迹图象 B.原子的吸收光谱
C.电子体积大小的图象 D.原子的发射光谱
(7)某元素原子的价电子构型为3d54S1,该元素属于
(2009?福建)[化学--物质结构与性质]
Q、R、X、Y、Z五种元素的原子序数依次递增.已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4.
请回答下列问题:
(1)Z2+的核外电子排布式是
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于
查看习题详情和答案>>
Q、R、X、Y、Z五种元素的原子序数依次递增.已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4.
请回答下列问题:
(1)Z2+的核外电子排布式是
1s22s22p63s23p63d9
1s22s22p63s23p63d9
.(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的
孤对电子(孤电子对)
孤对电子(孤电子对)
形成配位键.(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是
b
b
.a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为
Si<C<N
Si<C<N
(用元素符号作答)(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为
3:2
3:2
.(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于
原子晶体
原子晶体
.Q、R、X、Y、Z五种元素的原子序数依次递增.已知:①Z的原子序数为29,其余的均为短周期主族元素;②Y原子价电子(外围电子)排布msnmpn③R原子核外L层电子数为奇数;④Q、X原子p轨道的电子数分别为2和4.请回答下列问题:
(1)Z2+的核外电子排布式是
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是
A.稳定性:甲>乙,沸点:甲>乙 B.稳定性:甲>乙,沸点:甲<乙
C.稳定性:甲<乙,沸点:甲<乙 D.稳定性:甲<乙,沸点:甲>乙
(3)Q、R、Y三种元素的第一电离能数值由小到大的顺序为
(4)五种元素中,电负性最大与最小的两种非金属元素形成的化合物的化学式为
(5)Q的一种氢化物相对分子质量为28,其中分子中的σ键与π键的键数之比为
查看习题详情和答案>>
(1)Z2+的核外电子排布式是
1s22s22p63s23p63d9
1s22s22p63s23p63d9
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是
B
B
.A.稳定性:甲>乙,沸点:甲>乙 B.稳定性:甲>乙,沸点:甲<乙
C.稳定性:甲<乙,沸点:甲<乙 D.稳定性:甲<乙,沸点:甲>乙
(3)Q、R、Y三种元素的第一电离能数值由小到大的顺序为
Si<C<N
Si<C<N
(用元素符号作答).(4)五种元素中,电负性最大与最小的两种非金属元素形成的化合物的化学式为
SiO2
SiO2
.(5)Q的一种氢化物相对分子质量为28,其中分子中的σ键与π键的键数之比为
5:1
5:1
,该氢化物与氧气形成的燃料电池在碱性电解质中负极反应为C2H4+16OH--12e-=2CO32-+10H2O
C2H4+16OH--12e-=2CO32-+10H2O
.Q、R、X、Y、Z五种元素的原子序数依次递增.已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子排布为msnmpn;
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4.
请回答下列问题:
(1)Z2+的核外电子排布式是
(2)在[Z(NH3)4]2+离子中,Z2+的空轨道接受NH3分子提供的
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小至大的顺序为
(5)Q的一种氢化物相对分子质量为26,其分子中σ键与π键的键数之比为
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于
查看习题详情和答案>>
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子排布为msnmpn;
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4.
请回答下列问题:
(1)Z2+的核外电子排布式是
1s22s22p63s23p63d9
1s22s22p63s23p63d9
.(2)在[Z(NH3)4]2+离子中,Z2+的空轨道接受NH3分子提供的
孤电子对
孤电子对
形成配位键.(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是
b
b
.a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小至大的顺序为
Si<C<N
Si<C<N
(用元素符号作答).(5)Q的一种氢化物相对分子质量为26,其分子中σ键与π键的键数之比为
3:2
3:2
.(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于
原子晶体
原子晶体
(填晶体类型).