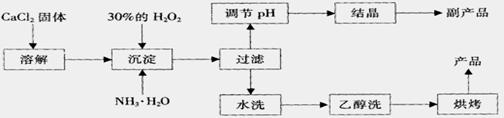
16.(9分)根据下列框图回答有关问题(答题时,方程式中的E用所对应的元素符号表示):
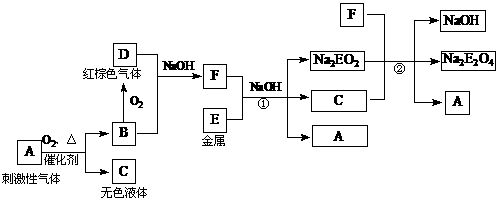
已知:Na2EO2溶于过量的新制氯水,形成黄色溶液,向该溶液中滴加KSCN溶液立即出现红色,振荡,一段时间后,红色褪去。
⑴A的电子式为 。
⑵写出反应②的化学方程式 。
⑶写出Na2EO2与新制氯水反应的离子方程式 。
⑷一段时间后红色褪去的原因可能是:
①E元素被氯水氧化为更高价态的物质;② 。
(5)一定条件下Na2E2O4可被氧化成Na2EO4 ,该物质可用于饮用水的处理理由是
|


|

 Cr3+
Cr(OH)3
CrO2-
Cr3+
Cr(OH)3
CrO2-
铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准。
(1)铬原子核中质子数为24,铬位于周期表中第_______周期_______族。
(2)FeSO4还原Cr2O72-的离子方程式为_______________________________________。
(3) Cr2 (SO4) 3溶液中加入过量NaOH浓溶液,反应的离子方程式为_______________。
(4)沉淀法分离废水中的Cr3+离子,pH应控制在 范围内。
(5)下列关于铬及其化合物的说法中正确的是 。
A.K2Cr2O7是一种常用的强氧化剂 B.NaCrO2溶液与AlCl3溶液混合有沉淀生成
C.酸性K2Cr2O7溶液可用于检验司机是否酒后驾车 D.Cr(OH)3为两性氢氧化物
E.金属铬硬度大、耐腐蚀,是常用的镀层金属
(6)冶炼铬工业的废渣粉碎后掺入煤矸石经过高温处理可以制砖,为了探究其中的铬元素在使用过程中是否会重新污染环境,研究组在一定条件下浸溶砖样,检测浸出液中Cr元素浓度,结果如图:
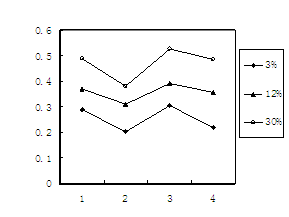
说明:1为用蒸馏水浸溶,2为用稀硫酸浸溶,3为冻融后用蒸馏水浸溶,4为曝晒后用蒸馏水浸溶;
3%、12%、30%为制砖时含铬废渣掺入的比例。
已知我国规定“固体废弃物浸出标准值含铬不得超过10 mg·L-1”。分析图表,可得下列结论正确的是: 。
A.其它条件相同时,含铬废渣掺入的比例越大,Cr元素浸出的浓度越高
B.酸性环境对Cr元素浸出有抑制作用 C.冻融对Cr元素浸出影响不明显
D.曝晒对Cr元素浸出影响不明显 E.上述砖样符合我国排放标准
18(8分).研究金属的冶炼对人类有重要意义。
(1)人类历史上大量生产和使用钠、铝、铁、铜四种金属单质的时间从先到后顺序是____ __
(2)铜的冶炼有火法冶炼和湿法冶炼写出火法炼铜的化学方程式(Cu2S为主原料)
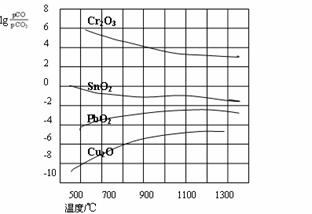 (3)右图是部分金属氧化物被一氧化碳
(3)右图是部分金属氧化物被一氧化碳
还原时lg[p(CO)/p(CO2)]与温度的关
系曲线图。则四种金属氧化物中:
Cr2O3、SnO2、PbO2、Cu2O,最易
被还原的金属氧化物是 ,
该反应的△H 0。
(4)下列说法正确是
A.氧化镁跟铝粉共热适于炼镁
B.不锈钢中含有金属和非金属元素
C.所有金属均以化合态存在于自然界
D.金属冶炼中还原剂可以是一些活泼金属
E.活泼金属的冶炼都是通过电解其盐溶液制得
F.金属提炼一般要经过矿石的富集、冶炼、精炼三步

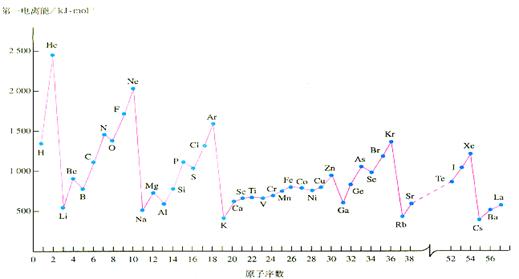 A.(12分)教材中给出的各物质的第一电离能的数据如下
A.(12分)教材中给出的各物质的第一电离能的数据如下
 ①
Cl2 ② KMnO4 ③ HNO3
①
Cl2 ② KMnO4 ③ HNO3  (9分)某同学对Cu与HNO3的反应进行如下探究。请回答有关问题。
(9分)某同学对Cu与HNO3的反应进行如下探究。请回答有关问题。
 (10分)已知方框内是食品香精菠萝酯的生产路线,A、C 又能发生方框外所示的转化关系。A、B、C的分子式分别C2H3ClO2、C8H8O3、C3H6O
(10分)已知方框内是食品香精菠萝酯的生产路线,A、C 又能发生方框外所示的转化关系。A、B、C的分子式分别C2H3ClO2、C8H8O3、C3H6O