14.(哈尔滨九中2008-2009高三第二次月考)分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 ;
 (2)如右图所示,仪器A的名称是_______________;在实验过程中,
(2)如右图所示,仪器A的名称是_______________;在实验过程中,
如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温
度,则测得的△H (填“偏大”、“偏小”或“无影响”);
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶
液的比热容c=4.18J/(g·℃)。为了计算中和热,某学生实验记录数据如下:
|
实验序号 |
起始温度t1℃ |
终止温度t2℃ |
|
|
盐酸 |
氢氧化钠 |
混合溶液 |
|
|
1 |
20.0 |
20.1 |
23.2 |
|
2 |
20.2 |
20.4 |
23.4 |
|
3 |
20.5 |
20.6 |
23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H=________________;(结果保留一位小数)
(4) (填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是 。
[解析]:(1)(2)见答案;(3)根据表中数据可知:平均温度升高3.1℃,混合物质量是
80g, Q=cm△T=4.18J/(g·℃)×80g×3.1℃=1.036KJ;所以1mol生成时的反应热为1.036KJ/0.02mol=-51.8 kJ/mol;(4)见答案。
[答案]:(1)1/2H2SO4(aq)+ 1/2 Ba(OH)2(aq)== 1/2BaSO4(s)+H2O(1);△H=-57.3kJ/mol
H+(aq)+OH-(aq)=H2O(1);△H = -57.3kJ·mol-1
(2)环形玻璃搅拌棒 偏大
(3)-51.8 kJ/mol
(4)不能, H2SO4与Ba(OH)2反应生成的BaSO4沉淀的生成热会影响反应的反应热
9.[皖南八校2009届高三第二次联考12月]一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+ 3H2O==2NH3+ O2.
O2.
进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
|
T/℃ |
30 |
40 |
50 |
生成NH3量/(10 mo1) mo1) |
4.8 |
5.9 |
6.0 |
请回答下列问题:
 (1)50℃时从开始到3 h内以O2物质的量变化表示的平均反应速率为
mol/min。
(1)50℃时从开始到3 h内以O2物质的量变化表示的平均反应速率为
mol/min。
(2)该反应过程与能量关系可用右图表示.完成反应的热化学方程式: 。
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议: 。
(4)工业合成氨的反应为N2(g)+3 H2(g) 2NH3(g)。设在容积为2.0 L的密闭容器中充人0.80 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的体积分数为20%。
2NH3(g)。设在容积为2.0 L的密闭容器中充人0.80 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的体积分数为20%。
① 该条件下反应2NH3(g) N2(g)十3H2(g)的平衡常数为
。
N2(g)十3H2(g)的平衡常数为
。
② 相同条件下,在另一相同容器中充人a mol N2(g)和b mo1 H2(g),达到平衡时,测得容器中NH3为0.8
mo1,H2为2.0 mol,则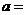 ,
,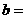 。
。
[解析]:(1)

(4)① N2(g)+ 3H2(g) 2NH3(g)
2NH3(g)
起始 /mol 0.80 1.60 0
/mol 0.80 1.60 0
转化 /mol
/mol  3
3 2
2
平衡n/mol 0.80- 1.60一3
1.60一3 2
2
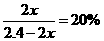
解得:
则
② 由温度相同知 设平衡时N2物质的量为
设平衡时N2物质的量为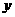
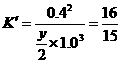

由等效转化可求起始时N2、H2的物质的量。
[答案]:(1)2.5×l0
(2)N2(g)+3H2O(1)=2NH3(g)+ O2(g)
O2(g)
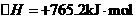
(3)升高温度;加压;不断移出生成物脱离反应体系(合理均可)
(4)①0.9375 ②0.7 3. 2
8.(哈尔滨九中2008-2009高三第二次月考)有关键能数据如表
|
化学键 |
Si-O |
O=O |
Si-Si |
|
键能/kJ·mol-1 |
X |
498.8 |
176 |
晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s);△H = -989.2kJ·mol-1,则X的值为
A.423.3 B.460 C.832 D.920
[解析]:每摩尔Si含有2molSi-Si键, 每摩尔 SiO2含有4molSi-O键,
则:△H =2×176 kJ·mol-1+498.8 kJ·mol-1- 4X kJ·mol-1 =-989.2kJ·mol-1,X=460
[答案]:B

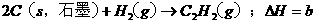
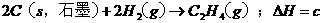
 ,
, ,则下列判断正确的是 ( C )
,则下列判断正确的是 ( C ) ,
, ,故正确选项为C。
,故正确选项为C。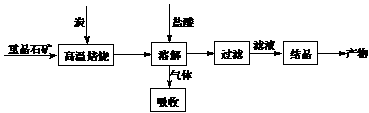
 4CO(g) + BaS(s)
△H1 = 571.2 kJ·mol-1 ①
4CO(g) + BaS(s)
△H1 = 571.2 kJ·mol-1 ① =
。
=
。  HS- +OH- HS- + H2O
HS- +OH- HS- + H2O C.已知N2(g)+3H2(g) 2 NH3(g)
;△H=-92.4 kJ·mol-1,则在一定条件下将
C.已知N2(g)+3H2(g) 2 NH3(g)
;△H=-92.4 kJ·mol-1,则在一定条件下将 mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是(
)
mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是(
)