22.(8分)化学中用类比的方法可预测许多物质的性质。如根据H2+C12=2HCl推测:H2+Br2=2HBr。但类比是相对的,如根据2Na2O2+2CO2=2Na2CO3+O2类推:2Na2O2+2SO2=2Na2SO3+O2是错误的,应该为:Na2O2+SO2=Na2SO4。
(1)下列各组类比中正确的是 (填序号);
|
|
B.由2Fe+3Cl2==2FeCl3 推测: 2Fe+3Br2==2FeBr3
C.由Na2SO3+2HCl=2NaCl + H2O+SO2↑ 推测:Na2SO3+2HNO3==2NaNO3+H2O+SO2↑
D.由I2易溶于KI溶液 推测: C12易溶于NaCl溶液
(2)由氧化铁与盐酸反应生成氯化铁和水,应用有关知识推断写出氧化亚铁与稀硝酸反应的化学方程式 ;
(3)电镀厂向含氰化物的电镀废液中加入漂白粉以消除有毒的CN-的化学方程式为 □CN-+□ClO-+□H2O =□HCO3-+□N2 +□Cl-,配平该反应的化学方程式,在方框中填上系数;
(4)(CN)2被称为拟卤素,它的阴离子CN-作为配体形成的配合物有重要用途。HgCl2 和Hg(CN)2反应可制得Hg2Cl2 和(CN)2,该反应的氧化产物是 。
21.(13分)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者的混合物。限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹、铁钉、3 mol·L-1H2SO4、0.01 mol·L-1KMnO4、NaOH稀溶液、0.1 mol·L-1KI、20%KSCN、蒸馏水。探究过程如下:
(1)查阅资料:Cu2O溶于稀硫酸生成Cu和CuSO4:Cu2O+2H+ = Cu + Cu2++ H2O;单质Cu能将Fe3+还原成Fe2+:2Fe3+ + Cu = 2Fe2+ + Cu2+。
(2)提出假设:
假设l:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是______________;
(3)实验过程:
设计实验方案证明你的假设;根据设计的实验方案,进行实验。请在答题卡上按下表格式写出实验操作步骤、预期现象。
|
|
实验操作 |
预期现象 |
结 论 |
|
操作1: |
|
|
假设1或假设3成立 |
|
操作2: |
|
|
假设1成立 |
|
|
假设3成立 |
||
|
操作3: |
|
|
假设2或假设3成立 |
|
操作4 |
|
|
假设2成立 |
|
|
假设3成立 |
20.(11分)某实验小组对FeCl3的性质和用途展开了实验。
实验一:
实验步骤
①往锥形瓶中加入50 mL、3.0%的双氧水。
②分别往锥形瓶中加0.5 g不同的催化剂粉末,立即塞上橡皮塞。
③采集和记录数据。
④整理数据得出下表。
表:不同催化剂催化双氧水分解产生O2的压强对反应时间的斜率
|
催化剂 |
氯化铁 |
二氧化锰 |
猪肝 |
马铃薯 |
|
压强对时间的斜率 |
0.0605 |
3.8214 |
0.3981 |
0.0049 |
(1)该“实验一”的实验名称是 ;
(2)催化效果最好的催化剂是 ;
实验二:氯化铁催化分解双氧水的最佳条件
该实验小组的同学在进行实验二时,得到了如下的数据。
表:不同浓度的双氧水在不同用量的FeCl3·6H2O作用下完全反应所需时间
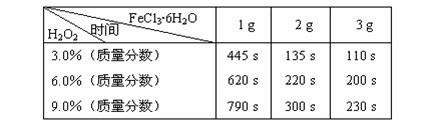
分析表中数据我们可以得出:
(3)如果从实验结果和节省药品的角度综合分析,当选用6.0%的双氧水时,加入______g FeCl3·6H2O能使实验效果最佳;
(4)进行该实验时,控制不变的因素有反应温度、 等;
(5)如图是2 gFeCl3·6H2O催化分解50 ml3.0%的
双氧水时收集到的O2体积对反应时间示意图,
请分别画出相同条件下1 g、3 g FeCl3·6H2O催
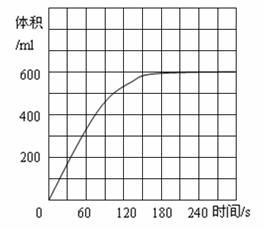 化分解50 ml3.0%的双氧水时收集到的同温同
化分解50 ml3.0%的双氧水时收集到的同温同
压下O2体积对反应时间示意图,并作必要的
标注;
讨论:有关FeCl3参加的可逆反应的两个问题:
(6)分别取若干毫升稀FeCl3溶液与稀KSCN
溶液,混合,溶液呈血红色。限用FeCl3、KSCN、
KCl三种试剂,仪器不限,为证明FeCl3溶液与
KSCN溶液的反应是一个可逆反应,至少还要进行
次实验;
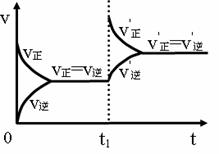 (7)一定浓度的FeCl3与KSCN两溶液反应达到
(7)一定浓度的FeCl3与KSCN两溶液反应达到
平衡,在t1时刻加入一些FeCl3固体,反应重新达
到平衡。若其反应过程可用如下的速率v-时间t
图像表示。请根据此图像和平衡移动规律求证新平衡下FeCl3的浓度比原平衡大
。
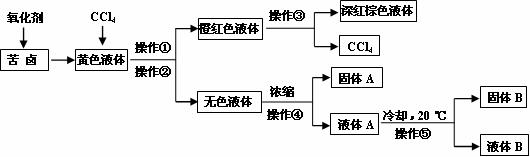 (11分)广东海岸线漫长,海洋盐矿资源丰富。有一研究性学习小组拟取某盐场制盐后的苦卤浓缩液(富含Mg2+、Br-、SO42-、Cl-等)制取较纯净的氯化镁晶体及液溴(Br2),他们设计了如下流程:
(11分)广东海岸线漫长,海洋盐矿资源丰富。有一研究性学习小组拟取某盐场制盐后的苦卤浓缩液(富含Mg2+、Br-、SO42-、Cl-等)制取较纯净的氯化镁晶体及液溴(Br2),他们设计了如下流程: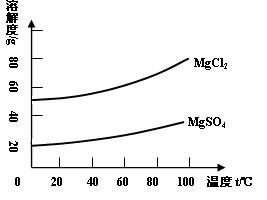
 某有机物的分子结构如图(图中棍表示单键、双键或叁键),它属烃或烃的含氧衍生物。关于该有机物的叙述正确的是
某有机物的分子结构如图(图中棍表示单键、双键或叁键),它属烃或烃的含氧衍生物。关于该有机物的叙述正确的是 2A(g) + 3B(g) xC(g) + yD(g) (x、y为正整数),反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol/(L·min),D的平衡浓度为0.3mol/L,又知v(B) : v(C)=3
: 2,则下列说法中正确的是
2A(g) + 3B(g) xC(g) + yD(g) (x、y为正整数),反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol/(L·min),D的平衡浓度为0.3mol/L,又知v(B) : v(C)=3
: 2,则下列说法中正确的是