20.(15分)氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H-H键能为436kJ·mol-1,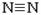 键能为945kJ·mol-1,N-H键能为391kJ·mol-1。写出合成氨反应的热化学方程式
。
键能为945kJ·mol-1,N-H键能为391kJ·mol-1。写出合成氨反应的热化学方程式
。
(2)恒温下,往一个2L的密闭容器中充入2. 6mol H2和1mol N2, 反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
|
时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
|
c(NH3)/mol·L-1 |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
5 min内,消耗N2的平均反应速率为 ,此条件下该反应的化学平衡常数K= ;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,化学平衡将向 方向移动(填“正反应”或“逆反应”)。
(3)氨是氮肥工业的重要原料。某化肥厂生产铵态氮肥 (NH4)2SO4的工艺流程如下:
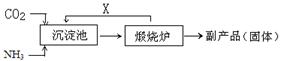
① 往沉淀池中装入CaSO4悬浊液后,需先通入足量NH3,再通入CO2的原因是
。
② 煅烧炉中产生的固态副产品为 ,生产流程中能被循环利用的物质X为 。
2009年福建省普通高中毕业班单科质量检查化学试题参考答案及评分标准
第Ⅰ卷 (选择题 共45分)
 2NH3 (g);△H =-93kJ·mol-1(3分)
2NH3 (g);△H =-93kJ·mol-1(3分)
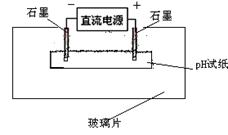 (3)如右图所示,取一张用CD溶液 浸湿的pH试纸平铺在玻璃片上,取两根石墨棒做电极,接通直流电源。一段时间后,b电极处的pH试纸上可观察到的现象是
(3)如右图所示,取一张用CD溶液 浸湿的pH试纸平铺在玻璃片上,取两根石墨棒做电极,接通直流电源。一段时间后,b电极处的pH试纸上可观察到的现象是