28.(16分)(1)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:


①在步骤a中,还需要通入氧气和水,其目的是 。
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在 范围。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Cu2+ |
1.9 4.7 |
3.2 6.7 |
不用加水的方法调节溶液pH的原因是 。
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明) 。
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是 。
 (3)右图是某小组同学查阅资料所绘出的硝酸铜晶体[ Cu(NO3)2·nH2O
]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是
(填字母)。
(3)右图是某小组同学查阅资料所绘出的硝酸铜晶体[ Cu(NO3)2·nH2O
]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是
(填字母)。
a. A点时的溶液为不饱和溶液
b. B点时两种晶体可以共存
c. 按上述流程最终得到的晶体是Cu(NO3)2·3H2O
d.若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2·6H2O晶体
(4)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离,如:2NH3 NH
NH +NH
+NH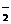 ,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是 ;Cu与液态N2O4反应制得无水硝酸铜的化学方程式是 。
,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是 ;Cu与液态N2O4反应制得无水硝酸铜的化学方程式是 。
13. 参照反应Br + H2
参照反应Br + H2 HBr +H的能量对反应历程的示意图,下列对上述正反应叙述中正确的 ( )
HBr +H的能量对反应历程的示意图,下列对上述正反应叙述中正确的 ( )
A. 反应热:过程I>过程Ⅱ B. 反应速率:过程Ⅱ=过程I
C. 该反应为吸热反应 D. 过程I使用了催化剂
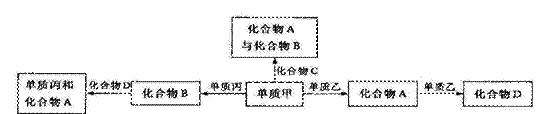 26、(18分)化合物A、B、C、D各由两种元素组成,甲、乙、丙是前两周期元素的三种单质。这些常见的化合物与单质之间存在如下关系(已知化合物C是一种有机物),回答以下问题:
26、(18分)化合物A、B、C、D各由两种元素组成,甲、乙、丙是前两周期元素的三种单质。这些常见的化合物与单质之间存在如下关系(已知化合物C是一种有机物),回答以下问题:
Ⅰ、(1)化合物物A的电子式为 ;化合物A、B、D的熔沸点从大到大小的顺序为 (用字母表示)。
(2)下列说法正确的是
 。
。
A、图中五个转化关系,有三个是化合反应 B、上述所涉及的化合物中有两种是电解质
B、上述所涉及的化合物中有两种是电解质
C、上述所涉及的化合物的晶体均是分子晶体 D、图中五个转化关系均为氧化还原反应
D、图中五个转化关系均为氧化还原反应
(3)用甲、丙、乙、氢氧化钾溶液可以构成一原电池,则电极材料可以为 ,负极的电极反应式为 。
Ⅱ.设反应①Fe(s)+CO2(g) FeO(s)+CO(g);△H=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)
FeO(s)+CO(g);△H=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)
 FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
|
T/K |
K1 |
K2 |
|
973 |
1.47 |
2.38 |
|
1 173 |
2.15 |
1.67 |
(1)从上表可推断,反应①是 (填“放”或“吸”)热反应。
(2)现有反应③H2(g)+CO2(g) CO(g)+H2O(g);△H=Q3平衡常数为K3。
CO(g)+H2O(g);△H=Q3平衡常数为K3。
①根据反应①与②,可推断反应③是 (填“放”或“吸”)热反应。要使反应③在一定条件下建立的平衡右移,可采取的措施有 。
A.缩小容器体积 B.降低温度 C.使用合适的催化剂
D.设法减少CO的量 E.升高温度
②根据反应①与②推导出Q1、Q2、Q3的关系式Q3= 。
 B.
B. C.
C. D.
D.

 CH3CH3↑+2CO2↑+H2↑+2KOH
CH3CH3↑+2CO2↑+H2↑+2KOH



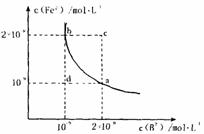 (4)某温度下,FeB(s) Fe2+(aq)+B2-(aq)
(4)某温度下,FeB(s) Fe2+(aq)+B2-(aq) B.pH=1的溶液中:Cu2+、Al3+、SO42-、NO3-
B.pH=1的溶液中:Cu2+、Al3+、SO42-、NO3- B.明矾水解的离子方程式:Al3++3H2O Al(OH)3+3H+
B.明矾水解的离子方程式:Al3++3H2O Al(OH)3+3H+ D.钢铁电化腐蚀时,负极反应为:Fe-2e-=Fe2+
D.钢铁电化腐蚀时,负极反应为:Fe-2e-=Fe2+