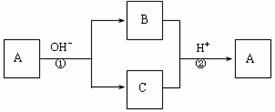
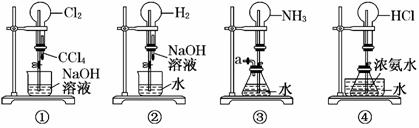
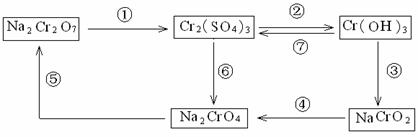
0 43047 43055 43061 43065 43071 43073 43077 43083 43085 43091 43097 43101 43103 43107 43113 43115 43121 43125 43127 43131 43133 43137 43139 43141 43142 43143 43145 43146 43147 43149 43151 43155 43157 43161 43163 43167 43173 43175 43181 43185 43187 43191 43197 43203 43205 43211 43215 43217 43223 43227 43233 43241 447348
 (2)脱碳。将CO2转化为甲醇的化学方程式为:
(2)脱碳。将CO2转化为甲醇的化学方程式为: CH3OH(g)+H2O(g)
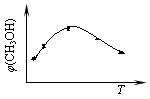
CH3OH(g)+H2O(g)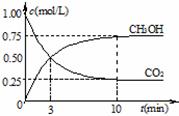 ② 在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是________
② 在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是________ CH3OH(g)+H2O(g)达到平衡状态的是______
CH3OH(g)+H2O(g)达到平衡状态的是______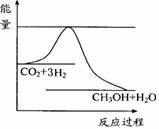 B.v(H2)=3v(CH3OH)
B.v(H2)=3v(CH3OH) A.使用新高效催化剂
B.充入He(g),使体系压强增大
A.使用新高效催化剂
B.充入He(g),使体系压强增大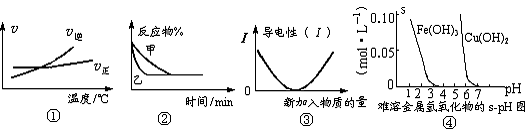
 2AB3(g)的ΔH>0
2AB3(g)的ΔH>0