摘要:13在容积为2L的密闭容器中.进行反应:A在不同温度下.C的物质的量n(C)和时间t的关系如图所示.试回答下列问题: (1)800℃时.0-5min内.以B的浓度变化表示的平均反应速率为 . (2)能判断该反应达到化学平衡状态的依据是 . a.容器中压强不变 b.混合气体中c(B)不变 c.2V正(B)=V逆(D) d.B.C.D的物质的量浓度比为2:1:1 e.容器中气体的密度不变 (3)若温度由800℃降至700℃.平衡常数K将 (填“增大 “减小 或“不变 ).理由是 . (4)若最初加入2.0molA和2.2molB.利用图中数据计算800℃时的平衡常数K.14.化合物A由周期不同的短周期元素X.Y组成.是良好的耐热冲击材料. (1)X的单质既可与盐酸反应.又可与NaOH溶液反应.X元素在元素周期表中的位置是 . (2)一定条件下.A和水缓慢作用生成含X元素的沉淀W和含Y的气态化合物Z.Z分子含有10个电子. ①往X的硫酸盐溶液中通入Z也有沉淀W析出.W的溶度积表达式KSP= . ②Z与H2O2反应.其产物之一是Y的单质.Y的单质的电子式为 . ③A的化学式是 . (3)将X与Mg形成的合金投入浓NaOH溶液中发生剧烈的原电池反应.其负极反应方程式为 . (4)X的单质.石墨和二氧化钛(TiO2)按比例混合.高温下反应得到的化合物均由两种元素组成.且都是新型材料.其反应的化学方程式是 .
网址:http://m.1010jiajiao.com/timu3_id_432152[举报]
 汽车尾气已成为重要的空气污染物.
汽车尾气已成为重要的空气污染物.(1)汽车内燃机工作时引起反应:N2(g)+O2(g)=2NO(g),是导致汽车尾气中含有NO的原因之一.T℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO 物质的量为6mol,该反应的速率v(NO)为
(2)H2或CO可以催化还原NO以达到消除污染的目的:
①已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式为
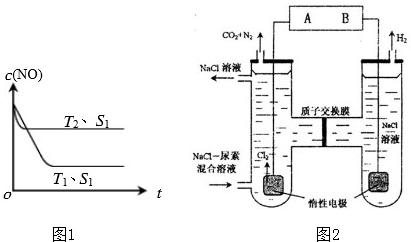
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图1是反应:
2NO(g)+2CO(g)=2CO2(g)+N2(g)中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H
(3)人工肾脏可用间接电化学方法除去代谢产物中的尿素(CO(NH2)2),即通过阳极反应生成具有强氧化作用的中间产物来氧化代谢产物,原理如图2:
①电源的负极为
②阳极室中发生的反应为
③电解结束后,阴极室溶液的pH与电解前相比将
(4)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气的转化率,则
| a |
| b |
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正