8. 在某温度下,相同pH的硫酸和硫酸铁溶液中由水电离出来的c(H+)分别是1.0×10-a mol·L-1和1.0×10-b mol·L-1,则在此温度下,下列说法中正确的是( )
A. a<b B. a=b
|
30.(16分)1,3-丙二醇(HOCH2CH2CH2OH)是重要的有机化工原料和药物中间体,目前1,3-丙二醇的生产路线有:以石油裂解气丙烯为原料的石化合成路线和以淀粉为原料的生物工程法合成路线。
|
 [路线1]丙烯醛水合氢化法:CH2=CHCH3
[路线1]丙烯醛水合氢化法:CH2=CHCH3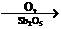 A(CH2=CHCHO)
A(CH2=CHCHO) 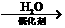 B(CH2-CH2-CHO)
B(CH2-CH2-CHO) 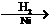 1,3丙二醇
1,3丙二醇
[路线2]生物发酵法:淀粉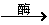 甘油
甘油 1,3丙二醇
1,3丙二醇
(1)有机物A含有的官能团的名称为
;反应A B的反应类型为
;写出B与Cu(OH) 2悬浊液共热反应的化学方程式:
B的反应类型为
;写出B与Cu(OH) 2悬浊液共热反应的化学方程式:
。
(2)从合成原料来源的角度看,你认为最具有发展前景的路线是 (填“路线1”或“路线2”),理由是 。
(3)以1,3-丙二醇、乙醇为原料合成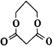 的流程图如下:
的流程图如下:
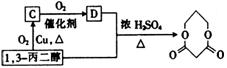
①C的结构简式为 。
②写出流程图中1,3-丙二醇与D反应生成 的化学方程式:
的化学方程式:
。
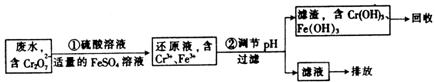
29.(13分)已知铬(Cr)的化合物有毒,由于+6价铬具有强氧化性,其毒性是+3价铬毒性的100倍,因此,必须对含铬的废水进行处理。某印染厂采用的处理方法主要有两种:
方法一:还原法
在酸性条件下用FeSO等还原剂将+6价铬还原成+3价铬。具体流程如下:
有关离子以氢氧化物形式完全沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)
2 |
Fe(OH)
3 |
Cr(OH)
3 |
|
完全沉淀时溶液的pH |
9.7 |
3.2 |
5.6 |
(1)写出步骤①中反应的离子方程式: 。
(2)Cr(OH) 3在碱性较强的溶液中将生成[Cr(OH) 4]-,步骤②中调节pH的范围为 (填字母)最好。
A. 3-4 B. 6-8 C. 10-11 D. 12-14
(3)若步骤①中的FeSO4适当过量,使Fe2+和Fe3+的比例恰当时,可变废为宝恰好生成具有磁性、组成类似于Fe3O4的铁氧体悬浮物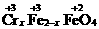 ,用于电子工业,则x= 。
,用于电子工业,则x= 。
方法二:电解法
将含+6价铬的废水充入电解槽内,以铁作电极,加入适量的NaCl进行电解,电解时阴极区放出H2,阳极区生成的Fe2+和Cr2O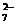 发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH) 3和Cr(OH) 3沉淀而除去。
发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH) 3和Cr(OH) 3沉淀而除去。
(4)阴极的电极反应式为 。
(5)电解一段时间后,测得溶液中Cr2O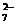 已全部被还原且c(Fe)3+=2×10-13 mol·L-1。已知溶液中c(Fe3+)·[c(OH-)]3=4.0×10-38 mol4·L-4,c(Cr3+)·[c(OH-)]3=6.0×10-31 mol4·L-4,则此时溶液中c(Cr3+)=
mol·L-1。
已全部被还原且c(Fe)3+=2×10-13 mol·L-1。已知溶液中c(Fe3+)·[c(OH-)]3=4.0×10-38 mol4·L-4,c(Cr3+)·[c(OH-)]3=6.0×10-31 mol4·L-4,则此时溶液中c(Cr3+)=
mol·L-1。
11. 类推的思维方法是化学学习和研究中常用的重要思维方法,但所得结论要经过实践的检验才能确定其正确与否。根据你所掌握的知识,判断下列类推结论中正确的是( )
|
|
化学事实 |
类推结论 |
|
A |
pH=3的盐酸稀释1000倍后pH=6 |
pH=6的盐酸稀释1000倍后pH=9 |
|
B |
用电熔融MgCl2的方法来冶炼金属镁 |
用电解熔融NaCl的方法来冶炼金属钠 |
|
C |
将SO2通入BaCl2溶液中无沉淀生成 |
将SO2通入Ba(NO3) 2溶液中也无沉淀生成 |
|
D |
Al在O2中燃烧生成Al2O3 |
Fe在O2中燃烧生成Fe2O3 |
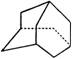 阻断病毒附着于敏感细胞的金刚乙胺,对于多种甲型流感病毒都具有很好的抑制作用,金刚乙胺可由金刚烷(结构如图所示)制得。金刚烷的一氯取代物的结构的( )
阻断病毒附着于敏感细胞的金刚乙胺,对于多种甲型流感病毒都具有很好的抑制作用,金刚乙胺可由金刚烷(结构如图所示)制得。金刚烷的一氯取代物的结构的( )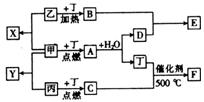
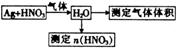
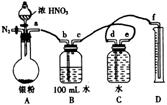
 反应结束后,从上图装置B所得100 mL溶液中取出25.00 mL溶液置于锥形瓶中,用0.10 mol· L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后滴定管中液面的位置如图所示。
反应结束后,从上图装置B所得100 mL溶液中取出25.00 mL溶液置于锥形瓶中,用0.10 mol· L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后滴定管中液面的位置如图所示。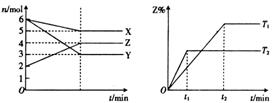
 2Z(g);
2Z(g);  B.
5X(g) + 3Y(g)
B.
5X(g) + 3Y(g)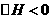
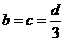 ,则反应的化学方程式可表示为5HClO3=O2↑+ Cl2↑+ 3HClO4 + H2O
,则反应的化学方程式可表示为5HClO3=O2↑+ Cl2↑+ 3HClO4 + H2O