网址:http://m.1010jiajiao.com/timu3_id_423746[举报]
 含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.已知:
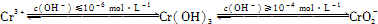
(1)在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去.
①写出Cr2O
2- 7 |
②用离子方程式表示溶液pH不能超过10的原因:
(2)将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O
2- 7 |
①写出阴极的电极反应式:
②电解法中加入氯化钠的作用是
(3)铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中.
①CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3].则该反应的化学方程式为
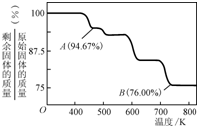
②CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示,则B点时剩余固体的成分是
含铬化合物有毒,对人畜危害很大。因此含铬废水必须进行处理才能排放。
已知: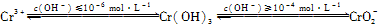
(1)在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去。
①写出Cr2O72-与FeSO4溶液在酸性条件下反应的离子方程式:________________。
②用离子方程式表示溶液pH不能超过10的原因:____。
(2)将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合成氢氧化物沉淀而除去。
①写出阴极的电极反应式:________________。
②电解法中加入氯化钠的作用是________________。
(3)铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中。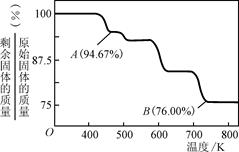
①CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为____。
②CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如右图所示,则B点时剩余固体的成分是________________(填化学式)。
 含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
已知: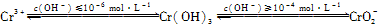
(1)在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去.
①写出Cr2O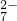 与FeSO4溶液在酸性条件下反应的离子方程式:______.
与FeSO4溶液在酸性条件下反应的离子方程式:______.
②用离子方程式表示溶液pH不能超过10的原因:______.
(2)将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O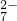 发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合成氢氧化物沉淀而除去.
发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合成氢氧化物沉淀而除去.
①写出阴极的电极反应式:______.
②电解法中加入氯化钠的作用是______.
(3)铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中.
①CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3].则该反应的化学方程式为______.
②CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示,则B点时剩余固体的成分是______(填化学式).
查看习题详情和答案>>
已知:

(1)在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去。
①写出Cr2O72-与FeSO4溶液在酸性条件下反应的离子方程式:________________。
②用离子方程式表示溶液pH不能超过10的原因:____。
(2)将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合成氢氧化物沉淀而除去。
①写出阴极的电极反应式:________________。
②电解法中加入氯化钠的作用是________________。
(3)铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中。

①CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为____。
②CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如右图所示,则B点时剩余固体的成分是________________(填化学式)。
(12分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法:
I.还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬。具体流程如下:
有关离子完全沉淀的pH如下表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(1)写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式__________________。
(2)还原+6价铬还可选用以下的________________试剂(填序号)。
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
则在操作②中可用于调节溶液pH的试剂为:_____________(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在____________(填序号)最佳。
A.3~4 B.6~8 C.10~11 D.12~14
II.电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去。
(4)写出阴极的电极反应式______________________________________。
(5)电解法中加入氯化钠的作用是:_______________________________________。
查看习题详情和答案>>