24.(7分)(1)在常温下浓度均为0.1mol/L的下列6种溶液的pH如下表:

 w_w w. k#s5_u.c o*
w_w w. k#s5_u.c o*
|
溶质 |
NaHSO3 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
|
pH |
5.8 |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
① 多元弱酸的正盐是分步水解的,第一步水解比第二步水解程度大得多,产生此规律的原因是_________________________________________________________________。
② 根据表中数据判断,常温时下列反应不能成立的是___________(填编号)。
a.CO2 + NaHSO3→NaHCO3+ SO2 b.CO2 +H2O +2C6H5ONa→Na2CO3+2C6H5OH
c.Na2CO3+C6H5OH→NaHCO3+C6H5Ona d.CH3COOH+NaCN→CH3COONa+HCN(2)已知在t℃,某Ba(OH)2稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,且a+b=16。
向该溶液中逐滴加入pH=c的盐酸,t℃下测得混合液的pH如下表所示:
|
序号 |
Ba(OH)2溶液体积/mL |
盐酸体积/mL |
混合液pH |
|
1 |
22.00 |
0 |
10 |
|
2 |
22.00 |
18.00 |
9 |
|
3 |
22.00 |
22.00 |
8 |
假设混合时体积变化忽略不计,则c为 。
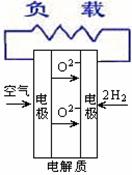
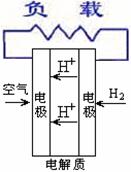
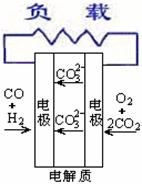
18. 燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。下面有4种燃料电池的工作原理示意图,其中正极的反应产物为水的是
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。下面有4种燃料电池的工作原理示意图,其中正极的反应产物为水的是

 w_w w. k#s5_u.c o*
w_w w. k#s5_u.c o*
A.固体氧化物燃料电池
|
B.碱性燃料电池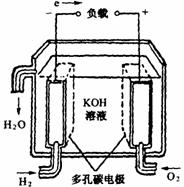 |
||||
C.质子交换膜燃料电池
|
D.熔融盐燃料电池
|
 ①
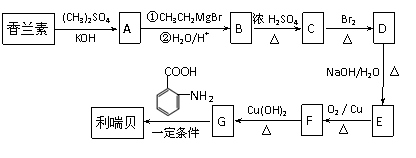
从香草豆等植物中可以提取香兰素,部分流程如下图所示。
①
从香草豆等植物中可以提取香兰素,部分流程如下图所示。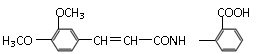 (2)以香兰素为原料,经过一系列转化,可以得到药物利喘贝
(2)以香兰素为原料,经过一系列转化,可以得到药物利喘贝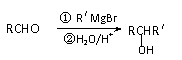

 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。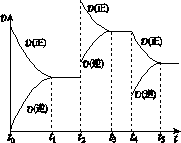 a.在t1 ~ t2时,可依据容器内气体的压强保持
a.在t1 ~ t2时,可依据容器内气体的压强保持
 =
。
=
。
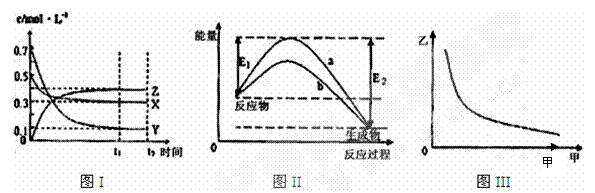
 A.该反应热化学方程式为X(g)
+3Y(g)
2Z(g) △H= ―(E2―E1)
A.该反应热化学方程式为X(g)
+3Y(g)
2Z(g) △H= ―(E2―E1)