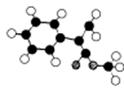
22. (本题12分)肉桂酸甲酯是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。它的分子式为C10H10O2,且分子中只含有1个苯环,苯环上只有一个取代基。现测出A的核磁共振氢谱谱图有6个峰,其面积之比为1︰2︰2︰1︰1︰3。利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如下图:
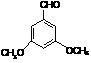
  (2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如右图所示
(图中球与球之间连线表示单键或双键)。 (2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如右图所示
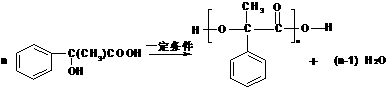
(图中球与球之间连线表示单键或双键)。用芳香烃A 为原料合成G的路线如下:  ① 化合物E中的官能团有 (填名称)。 ② A→B的反应类型是 ,E→F的反应类型是 , ③ 书写化学方程式 C→D  E→H E→H
④ 其中E的同分异构体甚多,其中有一类可用通式 表示(其中X、Y均不为H), 试写出符合上述通式且能发生银镜反应的 四种物质的结构简式 、 、 2009年天津市滨海新区五所重点学校高三毕业班联考 化学参考答案 一、1.A 2.B 3.C 4.D 5.B 6.A 7.D 8C 9.B 10.B 11.C 12.B 13.A 14.C 15A16.D 二、17、(1)2,10,2,1,3,5 (2)HNO3 (3)还原产物不止一种,NO与NO2比例不同时反应物的用量不同,系数不同 (4)a 取少量溶液 加KSCN溶液 出现红色 证明存在Fe3+ b 取少量溶液 逐滴加入高锰酸钾溶液,高锰酸钾紫色褪去 证明存在Fe2+ 18、(1) ① K= c(C)2 / c(A )· c(B)3 ② > ③ A ④ 2, >1-a (2) ① N2H62+ + H2O =可逆c([N2H5·H2O] +)+c(H+) ② D 19、(1)NaCl(2)HCl(3)2Cl- + 2H2O =电解= Cl2 ↑+ H2↑ + 2OH- Cl2+HSO3-+H2O = 2Cl- + SO42-+ 3H+ N2+ 3H2 高温高压催化剂= 2NH3 2Al + Fe2O3 高温= 2 Fe + Al 2O3 20、(1)2H2O2 = O2 ↑ +2H2O 电子式略 bc (2)①④(3)HS- + OH- = S2- +H2O (4)2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l);△H= -114.6KJ/mol (5)负 O2 +2H2O + 4e- = 4OH- ① 能自发进行的氧化还原反应(有电子转移) ② 正反应为发热反应 21、(1) F(2) 2NH4Cl+Ca(OH)2=加热= 2NH3 ↑ + CaCl2 +2H2O (3)6NO + 4NH3 催化剂加热= 5N2 +6 H2O (4)① 使NO与NH3 充分混合 (5)CCl4(难挥发有机溶剂) 缺少尾气处理 (6) B
18.(本题8分)(1)在一定体积的密闭容器中,进行如下化学反应:
请完成下列问题: ① 该反应的化学平衡常数表达式为K= 。 ② 判断该反应的ΔH 0(填“>”或“<”) ③ 在一定条件下,不能判断该反应已达化学平衡状态的是 (填序号)。 A.3v(B)(正)=2v(C)(逆) B.D的物质的量不变 C.容器内压强保持不变 D.混合气体的密度保持不变 ④398K、1.01×105Pa在1L的密闭容器中加入1molA和3molB,达平衡时A的转化率为a,在相同条件下的另1L容器中,若要达到与前一容器中相同的气体浓度,则需加入 molC, D的取值范围为 mol。 (2)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。 ①写出盐酸肼第一步水解反应的离子方程式 。 ②盐酸肼水溶液中离子浓度的排列顺序不正确的是 (填序号)。 A.c(Cl-) > c(N2H62+) > c(H+) > c(OH-) B.c(Cl-) > c(H+)> c([N2H5·H2O] +) > c(OH-) C.2 c(N2H62+)+ c([N2H5·H2O] +)+c(H+)= c(Cl-)+c(OH-) D.c(N2H62+) > c(Cl-) > c(H+) > c(OH-)
已知:反应①为氯碱工业的基础反应;X、Y为常见金属,Z为形成酸雨的主要成分 请回答下列问题: (1)写化学式A X (2)蒸干灼烧E所得酸性气体为 (3)完成下列方程式 反应①的离子反应方程式 B通入H溶液的离子反应方程式 空气中含量最高的气体与C反应的化学反应方程式 反应②的化学反应方程式
|







 (5)有同学认为,按上方案两种气体的体积比例不易得到很好的控制,提出改变装置连接顺序为
(5)有同学认为,按上方案两种气体的体积比例不易得到很好的控制,提出改变装置连接顺序为 A(g) + 3B(g) 2C(g) + D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
A(g) + 3B(g) 2C(g) + D(s) ΔH,其化学平衡常数K与温度t的关系如下表: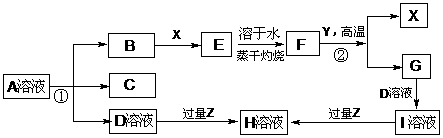 19. (本题11分)下图表示常见元素单质及化合物相应关系
19. (本题11分)下图表示常见元素单质及化合物相应关系